Пришло время открывать новые горизонты
В течение долгого времени исследователи сосредоточили свое внимание на пептиде бета-амилоиде в борьбе с болезнью Альцгеймера. Это не принесло никакого успеха. Поэтому, возможно, стоит пересмотреть причины заболевания.

На самом деле поиск эффективного лечения болезни Альцгеймера не должен быть непреодолимым препятствием. В то время как другие серьезные проблемы, влияющие на человечество, такие как насилие или нетерпимость, основаны на запутанной паутине причин и неопределенностей, болезнь Альцгеймера по сути является клеточно-биологической проблемой. На самом деле, возможно, решение даже дремлет в морозильной камере какой-нибудь исследовательской лаборатории. Кроме того, важную информацию можно было найти в больших базах данных и реестрах клиник. Или в нейропсихологических профилях, изображениях мозга, биологических маркерах в крови и спинномозговой жидкости, исследованиях генома и белка или в моделях животных и клеточных культур. Подсказки, которые мы, возможно, упускали из виду до сих пор, потому что мы потратили десятилетия слишком охотно гоняясь за каждым великим новым открытием, вместо того, чтобы углубляться в лежащие в основе биологические механизмы болезни.
В течение долгого времени наша работа основывалась на ряде предположений. Одним из них является тезис о том, что фрагмент белка бета-амилоид играет центральную роль в развитии заболевания. Большое количество данных поддерживает эту идею - и поэтому мы разработали препараты, снижающие концентрацию белковых фрагментов у пациентов с болезнью Альцгеймера. Но в целом это не останавливает снижение когнитивных функций. Поэтому сосредотачиваться на устранении или ингибировании бета-амилоида недальновидно. Тем более, что нам не хватает более глубоких и всесторонних знаний о том, как развивается и прогрессирует болезнь.
На протяжении десятилетий мы слишком охотно гонялись за каждым новым великим открытием вместо того, чтобы более внимательно изучать лежащие в основе биологические механизмы болезни
Пора вернуться к истокам. Я участвовал в исследованиях болезни Альцгеймера в течение трех десятилетий, в крупных проектах, изучающих семьи с высоким риском болезни Альцгеймера и стратегии ее предотвращения. Мы также внимательно изучили повреждение клеток головного мозга, которое играет важную роль в заболевании. Вместе с коллегами из различных научных и медицинских дисциплин я считаю, что нам необходимо пересмотреть физиологию и биологию болезни Альцгеймера. Есть как минимум пять направлений, которые, возможно, стоит изучить подробнее. Эти области лежат в основе открытий последних лет, и я считаю, что они, вероятно, приведут к пониманию, необходимому для поиска эффективных методов лечения.
Клетки мозга с проблемами утилизации
В начале 20-го века несколько невропатологов, в том числе Алоис Альцгеймер, в честь которого названа болезнь, описали микроскопические поражения в головном мозге пациентов, умерших от различных форм деменции. Сегодня мы знаем, что это скопления неправильно свернутых белков. В случае болезни Альцгеймера некоторые из этих агрегатов состоят из частей белка бета-амилоида. Они откладываются между нервными клетками и известны как старческие бляшки. Другие скопления находятся в нейронах. Эксперты называют их нейрофибриллярными клубками, и они содержат белок, называемый тау.
Есть как минимум пять направлений, которые стоит изучить
Сегодня, спустя более века, мы до сих пор не знаем, почему клетки не могут удалить эти отложения. Клеточные механизмы удаления дефектных белков на самом деле являются таким же "образом", как и сама жизнь. Почему они не работают при болезни Альцгеймера? Что здесь не так? Эти вопросы столь же важны для процесса болезни, как и вопрос о том, почему клетка теряет контроль над своим делением в случае рака. Некоторые недавние наблюдения исследователей, например, из Вашингтонского университета в Сент-Луисе, предполагают, что аномальные белки могут находить выход из клеток, потенциально уклоняясь от естественных систем распознавания. alt="
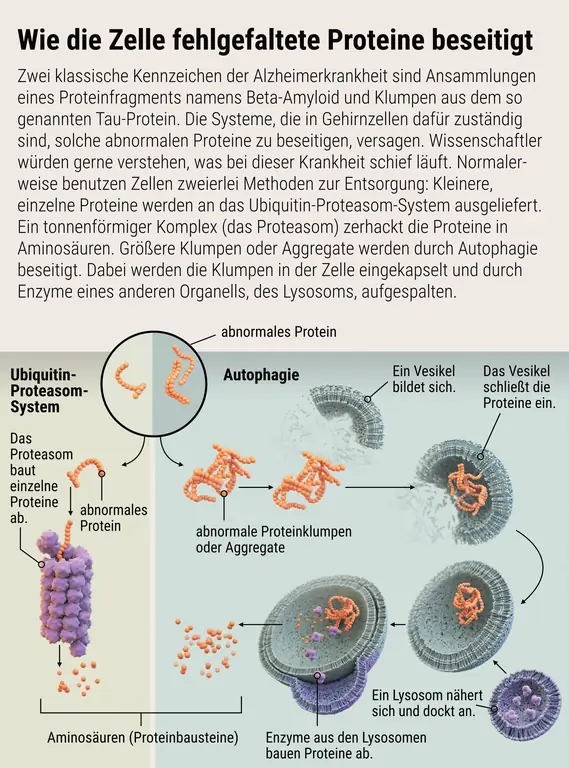
Аномальные белки утилизируются двумя основными системами: убиквитиновой протеасомной системой (UPS) и аутофагией. В первом случае белки вводятся в бочкообразную структуру, называемую протеасомой, где они разбиваются на части многократного использования. С помощью второй системы клетка укутывает аномальные белки и полностью их уничтожает. Нейроны также используют эти системы для управления своей связью и передачей сигналов. Во время обучения анатомические структуры, называемые аксонами, дендритами и синапсами, усиливаются или ослабевают.(Иногда нейроны также теряют поврежденные белки и оставляют их разрушение микроглии, определенным иммунным клеткам в мозге.)
Решение о том, транспортируется ли неправильно свернутый белок в сторону UPS или аутофагии, зависит в основном от его размера. Протеасома имеет узкие, похожие на поры отверстия на каждом конце, которые могут вместить небольшую нитевидную нить белка. Внутри находятся ферменты, расщепляющие белок на отдельные аминокислоты, которые повторно используются для синтеза новых белков. Более крупные белки с возрастными повреждениями или белковые глыбы, которые не вписываются в протеасому, направляются в систему аутофагии. У него есть более мощный механизм разрушения: лизосома.
С болезнью Альцгеймера явно что-то не так. Клетки мозга не могут избавиться от скоплений тау- и бета-амилоида, которые повреждают и удушают их. Таким образом, мы могли бы многое узнать о патологии болезни Альцгеймера, если бы смогли понять детали этих систем. Нам нужно искать специфические различия в путях распада в разных типах нейронов и выяснять точный механизм, с помощью которого системы распознают аномальные белки. Пороки развития белков и слипание не происходят за один шаг.
Белки могут накапливать мутации и модификации, способствующие неправильному свертыванию. Это может привести к их слиянию во все более крупные структуры посредством многоэтапного процесса. Вопрос в том, в какой момент срабатывают системы наблюдения и признают белки аномальными?
Неправильно сложенная веревка вызывает цепную реакцию
Интригующим открытием в этом контексте является то, что тау может ускользать из клеток в междоузлия и поглощаться соседними клетками. Неясно, является ли обмен белком между клетками нормальным или клетки только выплевывают аномальный тау, чтобы избавиться от токсического вещества. Мы подозреваем, что при болезни Альцгеймера, по крайней мере, часть тау-белка уже неправильно свернута вне клеток. Когда эти молекулы вторгаются в соседнюю клетку, они представляют собой своего рода паттерн, шаблон, который используют другие тау-белки в этой клетке для сборки таким же странным образом.
Наблюдение, что тау находится вне клеток, привело некоторых исследователей к предположению: возможно, в этот момент белок может быть захвачен и удален антителом, введенным пациенту. Однако этот подход, вероятно, не сработает; по крайней мере, пока мы точно не узнаем, как выглядит опасная форма тау. Но это была бы необходимая информация для разработки высокоспецифичного антитела.
Нам также нужно точно знать, где находится веревка. Пространство между клетками сложное. Перемещается ли белок через синапсы, которые два нейрона используют для передачи своих сигналов? В этом случае другие подходы могут оказаться более перспективными. Это связано с тем, что так называемая синаптическая щель является узкой и труднодоступной для антител. Нам нужно точно понять, как тау высвобождается из клеток и какие рецепторы используют соседние клетки для захвата белка. Недавние эксперименты в моей лаборатории, по крайней мере, позволяют предположить, что такой рецептор может существовать.
Какие изменения несут белки?
Несколько лет назад исследователям удалось с помощью методов визуализации визуализировать аномальный тау-белок с ранее неизвестным уровнем детализации внутри клеток, что является важным достижением в исследованиях болезни Альцгеймера. Изображения, опубликованные в журнале Nature в 2017 году, показали тысячи тау-белков, закрепленных парами в С-образной конфигурации. Возможно, детали этой структуры могут предоставить информацию, необходимую для создания небольших молекул, которые будут плотно прилегать к ее щелям. Разделив агрегированные белки, можно было бы остановить процесс болезни.
Но прорваться сквозь эти структуры сложно по многим причинам. Не в последнюю очередь потому, что клубок удерживается сильными связующими силами. Более многообещающей стратегией могло бы быть выяснение того, при каких обстоятельствах тау-белки переключаются из своего нормального жидкоподобного состояния в жесткое и твердое состояния.
Переход из жидкого состояния в твердое называется фазовым переходом. Появляется все больше доказательств того, что такие процессы в живых клетках могут играть роль в развитии заболеваний. Соответственно, все больше и больше биологов интересуются такими процессами. Физикохимики уже много лет изучают, как ведут себя капли масла в воде: и те, и другие являются жидкостями, но остаются разделенными из-за баланса сил притяжения и отталкивания. Это также называется фазовым разделением.
Преимущество разделения фаз для живых клеток состоит в том, что они могут накапливать определенный набор молекул в одном месте - там, где они нужны для конкретной деятельности. Например, несколько белков собираются рядом с геном, чтобы контролировать его экспрессию, как показали ученые в статье 2018 года, опубликованной в журнале Science. Такой концентрированный набор белков удерживается как капля слабыми физическими силами. Следовательно, такие агрегаты белков могут двигаться и работать вместе, не будучи завернутыми вместе в мембрану. Это экономит энергию, так как последняя потребовала бы ресурсоемкого обслуживания со стороны ячейки.
Клетки часто упаковывают белки и другие молекулы, склонные к фазовым переходам, в безмембранные органеллы, называемые стрессовыми и РНК-гранулами. Когда определенные белки и генетический материал, РНК, объединяются в такие гранулы, они плотно упаковываются, но обычно остаются жидкими. Однако выше определенной плотности они имеют тенденцию к большему слипанию и могут стать твердыми. Это увеличивает их способность вызывать повреждение головного мозга и затрудняет их удаление системами утилизации клеток. Поэтому нам нужно лучше понять обстоятельства, запускающие этот процесс.
Влияние генов
У людей среднего возраста болезнь Альцгеймера может быть результатом мутаций в трех генах (названных APP, PSEN1 и PSEN2). Они вызывают редкую наследственную форму заболевания. Однако в подавляющем большинстве случаев болезнь Альцгеймера возникает у людей старше 65 лет, у которых нет мутации в этих генах. Просматривая десятки тысяч геномов, генетики наткнулись на большее количество изменений ДНК: около двух десятков вариантов генов, по-видимому, связаны с несколько повышенным риском развития болезни Альцгеймера. Наиболее влиятельной из них является версия гена APOE, известная как вариант e4. Сочетание нескольких вариантов генов риска увеличивает вероятность развития заболевания. (По крайней мере, насколько мы можем судить на данный момент. Определенные варианты генов обычно также связаны с этническим происхождением человека. В настоящее время в основном доступны данные анализов и регистров генов европеоидов. оценка генетического риска во всех популяциях, поэтому необходим еще более обширный набор данных.)
Каждый из этих вариантов открывает разные двери. Некоторые из наиболее распространенных изменений - и, следовательно, самые интересные двери - можно найти в геноме микроглии, которая действует как иммунные клетки в центральной нервной системе. В исследовании 2019 года ученые обнаружили в этих клетках мутацию гена BIN1, которая, по-видимому, связана с повышенным риском развития болезни Альцгеймера. BIN1 обычно участвует в процессе поглощения микроглией потенциально вредных молекул. Таким образом, они защищают нейроны в окружающей их среде. Мутации в этом гене могут влиять на то, насколько эффективно микроглия очищает от паразитных белков.
Когда мозг обнаруживает источник повреждения, такой как амилоидные бляшки или слипшиеся нейрофибриллярные клубки, он бьет тревогу, выпуская поток химических мессенджеров, называемых цитокинами. Он также высвобождает многочисленные агрессивные иммунные клетки. Все это в значительной степени исходит от микроглии, вызывая воспалительную реакцию, направленную на разрушение тканей, в которых находятся нарушители спокойствия. Эта врожденная, довольно грубая система работает совсем иначе, чем более сложный адаптивный иммунный ответ. Через некоторое время это производит иммунные клетки и антитела, которые специфически распознают и атакуют определенных захватчиков, таких как бактерии или вирусы.
При болезни Альцгеймера доминирует врожденная реакция. Распространяющиеся источники повреждений превышают системы утилизации нервных клеток: они не в состоянии избавиться от белковых отходов. К сожалению, возникающая в результате воспалительная реакция часто затрагивает и здоровые клетки головного мозга. Ученые из Калифорнийского университета недавно обнаружили, что удаление старой микроглии и замена ее свежей микроглией, по-видимому, помогает пожилым мышам. Это улучшило пространственную память животных и обратило вспять возрастные изменения в экспрессии нейронных генов. В то же время формировалось больше новых нейронов, а дендриты, отростки нервных клеток, в среднем становились толще.
Атака, вызванная бета-амилоидом и тау, скорее всего, произойдет, когда в мозгу уже есть легкое воспаление. Это вполне нормально с возрастом: у многих пожилых людей повышен уровень провоспалительных цитокинов, таких как фактор некроза опухоли (ФНО). Это говорит о том, что все ее тело находится в стойком, слегка воспаленном состоянии.
Однако процесс старения сильно отличается от человека к человеку. Это означает, что течение и последствия болезни Альцгеймера могут сильно различаться. Некоторая часть этой изменчивости, вероятно, связана с индивидуальными различиями в иммунной системе, некоторые из которых являются генетическими. Мы также подвергаемся воздействию различных патогенов на протяжении всей нашей жизни и переносим различные микробы в нашем кишечнике. Все это приводит к формированию индивидуального иммунного профиля или «иммунотипа», влияющего на риск заболевания.
Разграничение «хороших» и «плохих» иммунных реакций является сложной задачей для исследователей. Ведь мы не хотим влиять на реакции, которые инициирует мозг, чтобы быстро устранить источники повреждений или нормальные, возрастные процессы деградации. А вот другие, чрезмерные реакции, сопровождающие прогрессирование болезни, действуют. Мы пока точно не знаем, как это можно сделать.
Помехи электрическим сигналам
Мозг кодирует информацию в виде электрических сигналов, которые передаются между нейронами. Обычно это делается с помощью веществ, называемых нейротрансмиттерами. Пока неясно, как болезнь Альцгеймера влияет на передачу сигналов между клетками мозга и мешает им формировать функциональные цепи. Однако благодаря техническим достижениям мы все лучше и лучше распознаем как структурные, так и функциональные связи и представляем их в деталях.
Некоторые из этих достижений основаны на оптогенетике, методе, позволяющем стимулировать светом определенные клетки мозга животного. Как показывает исследование 2020 года, исследователи смогли наблюдать и манипулировать особыми нейронами, которые вместе образуют след памяти, называемый инграммой. Если позже снова стимулировать клетки животных светом, это возвращает память о событии. Как нейробиологи также обнаружили в 2020 году, микроглия, по-видимому, участвует в том, что мозг снова забывает такие инграммы: иммунные клетки устраняют синапсы, которые обычно соединяют нейроны.
На нейротрансмиттеры также влияют белки, вовлеченные в патологию Альцгеймера. Тау, например, накапливается в нейронах, которые используют глутамат в качестве мессенджера и передают возбуждающие сигналы. С другой стороны, нервные клетки, которые подавляют передачу сигнала, полагаются на другой нейротрансмиттер, ГАМК. На них меньше влияет накопление тау. Этот дисбаланс может иметь последствия, которые пока неизвестны.
И не только отдельные типы клеток иногда поражаются в разной степени патологическим процессом: болезнь Альцгеймера также влияет на различные области мозга в разной степени. Например, области, связанные с памятью, эмоциями и сном, часто сильно поражаются, в то время как центры, отвечающие за двигательную и сенсорную функции, в значительной степени остаются нетронутыми. Согласно исследованию, бета-амилоидные бляшки сначала откладываются в тех областях мозга, которые становятся активными, когда мы позволяем нашему уму блуждать. Эта сеть также называется «сетью режима по умолчанию» или сетью гибернации. Однако было бы преждевременно делать вывод, что отложение амилоида вызывается блуждающим призраком.
Сон, с другой стороны, похоже, играет определенную роль в развитии болезни Альцгеймера. Уровни бета-амилоида и тау колеблются в течение нормального цикла сна-бодрствования. Если мы спим мало или вообще не спим, это способствует образованию агрегатов и уменьшает их распад. Глубокий сон, с другой стороны, вызывает ритмичные движения спинномозговой жидкости, которые могут служить для выведения токсинов, в том числе белковых агрегатов, из мозга. К сожалению, эта форма сна уменьшается с возрастом. Это также может сделать их возможной отправной точкой для терапии болезни Альцгеймера.
