Преобразование нервных клеток в светочувствительные направлено на восстановление зрения у некоторых слепых пациентов
Мужчина, который был слеп в течение 50 лет, позволил ученым вставить ему в глаз крошечный электрический зонд.
Зрение мужчины было разрушено, и фоторецепторы или светособирающие клетки в задней части его глаза больше не работали. Эти клетки, известные как палочки и колбочки, являются основой человеческого зрения. Без них мир становится серым и бесформенным, хотя и не совсем черным. Зонд был нацелен на другой набор клеток сетчатки, ганглиозные клетки, которые вместе с соседними биполярными клетками передают визуальную информацию от палочек и колбочек в мозг.
Никто не знал, функционируют ли эти передающие информацию клетки, когда палочки и колбочки вышли из строя. Когда ученые послали импульсы электричества к ганглиозным клеткам, мужчина описал, как видел маленькую тусклую свечу, мерцающую вдалеке. Этот тусклый маяк был признаком того, что ганглиозные клетки все еще могут посылать сообщения в мозг для преобразования в изображения.
Этот эксперимент 1990-х годов и другие, подобные ему, зажгли новое видение у исследователя Чжуо-Хуа Пана из Университета Уэйна в Детройте. Он и его коллега Александр Дижоор задались вопросом, могут ли ученые вместо того, чтобы щекотать клетки электричеством, трансформировать их, чтобы они воспринимали свет и делали то, что палочки и колбочки больше не могли.
Подход является частью новой революционной области под названием оптогенетика. Оптогенетики используют молекулы водорослей или других микроорганизмов, которые реагируют на свет, или создают новые молекулы, которые делают то же самое, и вставляют их в нервные клетки, которые обычно непроницаемы для света. Облучая молекулы светом определенной длины волны, исследователи могут контролировать активность нервных клеток.
Оптогенетика - мощный инструмент для исследования внутренней работы мозга (SN: 30.01.10, стр. 18). На мышах исследователи использовали оптогенетику для изучения пищевого поведения (SN: 07.03.15, стр. 8), картирования контуров агрессии (SN: 21.03.15, стр.18) и даже изменять воспоминания (SN: 04.10.14, стр. 6; SN: 24.08.13, стр. 18).
Сезам, откройся
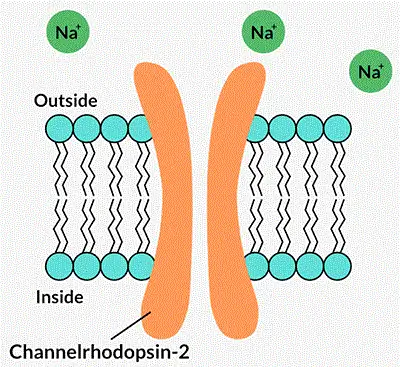
Оптогенетика предполагает введение белка водорослей в мембрану нервной клетки. В темноте белок, называемый каналродопсином-2, или ChR2, закрыт. Когда синий свет попадает на него, канал открывается и позволяет ионам течь внутрь. Это заставляет клетку посылать сигнал другим клеткам.
Источник: Eye: John Martin Barrett et al/Visual Neuroscience 2014 (CC-BY-NC-SA 3.0), адаптировано J. HIRSHFELD
После многих лет работы с животными исследователи теперь готовы вставлять оптогенетические молекулы в клетки сетчатки людей. Цель состоит в том, чтобы восстановить зрение у тех, у кого не работают палочки и колбочки.
«Разумеется, в первую очередь [оптогенетика] выиграет от светочувствительного органа», - говорит Хосе-Ален Сахель, директор Института зрения в Париже. Он участвует в одной из двух попыток перенести оптогенетику из лаборатории в глазную клинику.
Исследования на людях могут начаться в следующем году.
Обойти ущерб
Оптогенетика по своей сути является генной терапией. Традиционная генная терапия помещает здоровую копию мутировавшего или поврежденного гена в клетки человека с наследственным заболеванием. Здоровая копия сначала упаковывается в вирус. Вирус доставляет ген в «сломанные» клетки и выгружает свой груз. Оказавшись внутри клетки, ген производит функциональные копии белков, поврежденных первоначальными мутациями, и клетка снова начинает работать.
Этот тип генной терапии широко используется для лечения детей, рожденных с дефектами иммунной системы (SN: 8/10/13, стр. 19). Он также частично восстановил зрение у людей с редким типом наследственной слепоты, называемым врожденным амаврозом Лебера (SN: 24.05.08, стр. 8; см. «Не бояться темноты»).
Этот тип слепоты, однако, является наилучшим сценарием для генной терапии, говорит нейробиолог Ботонд Роска. Пациенты с LCA, подходящие для генной терапии, все еще имеют светособирающие палочки и колбочки в сетчатке, но клетки не работают должным образом, потому что у них есть мутация в гене, называемом RPE65 (одна из дюжины генных мутаций, которые могут вызывать LCA). Введение нормальной версии гена позволяет палочкам и колбочкам снова функционировать. Тем не менее, два исследования, опубликованные онлайн в этом месяце в Медицинском журнале Новой Англии, показывают, что даже у пациентов, у которых наблюдается улучшение зрения после генной терапии LCA, фоторецепторы продолжают умирать, а зрение со временем ухудшается (SN Online: 03.05.15).. Это может означать, что для долгосрочной выгоды необходим другой подход.
Большинство людей с наследственной слепотой не имеют даже надежды на временное выздоровление. Мутации в любом из более чем 250 генов могут привести к слепоте, говорит Джон Флэннери, клеточный и молекулярный биолог из Калифорнийского университета в Беркли. По его словам, в настоящее время генная терапия непрактична или невозможна для большинства этих заболеваний.
Приблизительно 200 000 человек в Соединенных Штатах унаследовали заболевания сетчатки, поражающие палочки и колбочки, согласно оценкам Фонда борьбы со слепотой. Как только эти фоторецепторы исчезнут, их уже не вернуть, говорит Роска из Института биомедицинских исследований им. Фридриха Мишера в Базеле, Швейцария.
Подход оптогенетики, который изучают Пан и другие, позволяет обойти отсутствующие фоторецепторы. Это означает, что она существенно отличается от традиционной генной терапии: она не исправляет сломанные гены, поэтому терапия должна работать независимо от того, какой из 250 генов вызывает проблемы. И вместо того, чтобы пытаться воскресить мертвые или поврежденные фоторецепторы, ученые стремятся превратить релейные клетки в суррогатные фоторецепторы.
Пан и Дижур начали обсуждать идею сделать биполярные и ганглиозные клетки чувствительными к свету в 2000 году. В принципе, это звучало просто: просто переместите светочувствительный белок палочек, известный как родопсин, в другой. клетки. Но родопсин не работает в одиночку. Это часть управляемой светом машины в глазу, состоящей из более чем дюжины частей, говорит Дижхур, молекулярный биолог, работающий в настоящее время в Университете Салуса в Элкинс-Парке, штат Пенсильвания. говорит. Исследователям нужна была простая молекула, которая могла бы сделать ганглиозные и биполярные клетки чувствительными к свету.
Прорыв произошел два года спустя, когда ученые обнаружили чувствительный к свету белок под названием каналродопсин в одноклеточной водоросли Chlamydomonas reinhardtii.
Retina redux
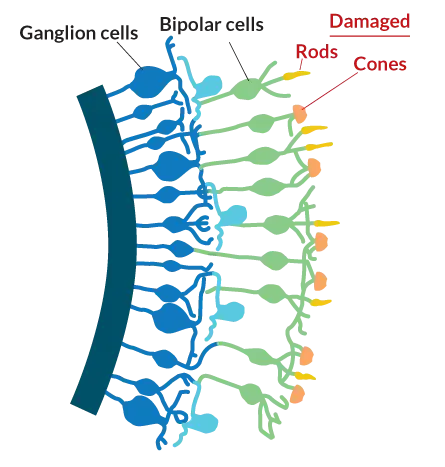
Многие наследственные состояния слепоты, а также заболевания глаз, такие как дегенерация желтого пятна, приводят к гибели палочек и колбочек в сетчатке или лишению их светочувствительных частей. Биполярные клетки и ганглиозные клетки, которые остаются, функционируют еще долгое время после исчезновения фоторецепторов, что делает эти клетки основными мишенями для оптогенетической терапии.
Источник: webvision.med.utah.edu, адаптировано Дж. Хиршфельдом
Channelrhodopsins образуют каналы во внешней мембране клетки. Когда определенные длины волн света попадают на белок, канал открывается и позволяет положительно заряженным ионам течь в клетку. Этот поток энергии является сигналом нервной клетки поговорить со своими соседями и с мозгом. Пан и Дижур сразу оценили его потенциал.
«Мы подумали: «Вау! Это молекула, которую мы ждали», - говорит Пан.
Они потеряли немного времени, упаковав ген, кодирующий специфический канальный родопсин, ChR2, в вирус, который мог инфицировать ганглиозные клетки у слепых мышей. Исследователи сообщили в журнале Neuron в 2006 году, что этот белок может сделать клетки чувствительными к свету и послать сообщение в мозг в ответ на свет синего света в глаза мышей (SN: 08.04.06, стр. 211).
Стайка ганглиозных клеток
Эксперимент был лишь первым шагом к восстановлению зрения. Исследователям пришлось столкнуться с вопросом, какая из клеток - ганглиозная или биполярная - может восстановить зрение в наибольшей степени. У каждого типа клеток есть свои плюсы и минусы.
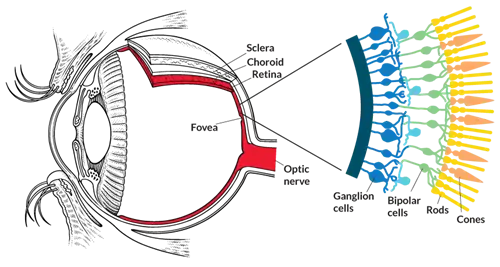
Чтобы понять эту дилемму, требуется некоторое понимание того, как работает глаз. Свет попадает в глаз через зрачок и фокусируется на сетчатке, тонкой многослойной ткани в задней части глаза.
Свет сначала сталкивается с ганглиозными клетками сетчатки. Эти нервные клетки имеют длинные хвосты, которые соединяются вместе, образуя зрительный нерв и отправляя в мозг сообщения о том, что обнаруживает глаз. Обычно они не чувствительны к свету. Как и биполярные клетки, следующий слой клеток, на которые падает свет. Под обоими этими слоями, в самой задней части глаза, находятся светочувствительные палочки и колбочки. Биполярные клетки собирают световую информацию от этих фоторецепторных клеток и передают ее ганглиозным клеткам, которые отправляют ее в области обработки зрительной информации в мозгу. В отличие от глаз мыши, человеческие глаза имеют крошечное окно, называемое ямкой, где биполярные клетки и ганглиозные клетки располагаются сбоку, позволяя свету падать прямо на фоторецепторы.
Ганглионарные клетки являются наиболее доступными, что делает их привлекательными для оптогенетики. Но человеческие глаза содержат около 20 различных типов ганглиозных клеток сетчатки, каждый из которых может передавать в мозг немного отличающуюся визуальную информацию.
Разнообразие может оживить жизнь, но потенциально оно является основным ударом по ганглиозным клеткам как мишени для оптогенетики. Это потому, что вирусы, используемые для доставки оптогенетических молекул, не могут различать различные ганглиозные клетки. Оптогенетики и генные терапевты отдают предпочтение вирусам, называемым аденоассоциированными вирусами, для доставки своего груза. Вирусы поставляются в различных упаковках, которые определяют, какие типы клеток они могут инфицировать, но никто не разработал упаковку, которая будет стыковаться только с определенными типами ганглиозных клеток.
Проблема, таким образом, заключается в том, что оптогенетические белки могут создаваться и активироваться одновременно во всех 20 разновидностях ганглиозных клеток, включая те, которые посылают противоречивую информацию в мозг, говорит Сахел в Париж. «Это все равно что сказать «да» и «нет» одному и тому же, - говорит он.
Биполярная экспедиция
Дизхур всегда думал, что биполярные клетки - это то, что нужно. Ведь они являются естественными посредниками между фоторецепторами и ганглиозными клетками. Если их связи с ганглиозными клетками все еще сохраняются в дегенеративной сетчатке, активация биполярных клеток, которые бывают двух основных разновидностей, должна давать менее шумную картину мира, чем 20 типов ганглиозных клеток, болтающих одновременно.
Биполярные клетки описываются как включенные или выключенные. Биполярные клетки ВКЛ активируются, когда уровень освещенности увеличивается, например, когда вы включаете лампу в темной комнате или выходите на улицу под яркий солнечный свет. Биполярные клетки ВЫКЛ возбуждаются, когда уровень освещенности снижается. В 2008 г. Рошка и его коллеги поместили ChR2 в биполярные клетки ON у слепых мышей, что позволило им видеть узор примерно в два раза лучше, чем у мышей с нормальным зрением (SN: 24.05.08, стр. 8).
До сих пор исследователи не продемонстрировали, что нацеливание на биполярные клетки рисует более четкую картину мира, чем нацеливание на ганглиозные клетки. Кроме того, биполярные клетки труднодоступны. Вирусы необходимо вводить под сетчатку, рискуя отслоением хрупкой ткани.
Независимо от того, на какие клетки они нацелены, исследователи настолько хорошо научились использовать оптогенетику для восстановления зрения у слепых мышей, что каждый эксперимент практически гарантированно сработает, говорит Роска. Новые исследователи в его лаборатории часто ошибочно принимают слепых мышей, прошедших оптогенетическую терапию, за мышей с нормальным зрением. К сожалению, опыт работы с мышами не облегчает перенос технологии на людей, говорит он. «Вы должны реорганизовать все, что у вас есть».
Держитесь подальше
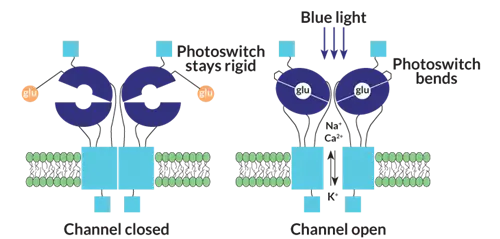
Изменив белок, участвующий в коммуникации нервных клеток, ученые надеются создать более чувствительный фотопереключатель для оптогенетической терапии. В темноте сконструированный белок, светозависимый ионотрофный рецептор глутамата, или LiGluR, удерживает глутамат вне досягаемости. Под действием света фотопереключатель изгибается, поэтому белок может захватить глутамат и открыть ионный канал. Затем клетка сигнализирует своим соседям, что свет существует.
Источник: Стефани Собота и др./Neuron, 2007 г., адаптировано Дж. Хиршфельдом
Сахель, Рошка и несколько других ученых объединились, чтобы создать в Париже компанию под названием GenSight Biologics. Цель состоит в том, чтобы разработать генную терапию и оптогенетическую терапию для людей с одной из наиболее распространенных генетических форм слепоты, заболеванием, разрушающим сетчатку, называемым пигментным ретинитом, а также для людей с некоторыми редкими заболеваниями глаз. И GenSight, и RetroSense Therapeutics со штаб-квартирой в Анн-Арборе, штат Мичиган, надеются начать клинические испытания к концу 2016 г. Хотя они используют схожие подходы, в конечном итоге они могут не нацеливаться на одни и те же клетки.
GenSight все еще взвешивает варианты. RetroSense нацеливает свою оптогенетическую терапию на ганглиозные клетки, в основном потому, что к этим клеткам легко получить доступ с помощью инъекции в центр глаза.
Ганглионарные клетки сетчатки также обладают выносливостью. При пигментном ретините первыми повреждаются фоторецепторы. Обычно палочки поддаются, затем колбочки. Позже могут отмирать и биполярные клетки. Но даже «на очень позднем этапе болезни ганглиозные клетки все еще присутствуют», - говорит главный врач RetroSense Питер Фрэнсис. По его словам, если этот подход сработает, пациенты, получающие оптогенетическую терапию, направленную на ганглиозные клетки сетчатки, смогут сохранить свое новое зрение на десятилетия.
Монохроматический ответ
То, какие клетки сделаны светочувствительными, не является единственным фактором, определяющим, насколько хорошо люди могут видеть. Важны сами оптогенетические молекулы.
Фоторецепторы, которые обнаруживают свет в глазах человека, работают в широком диапазоне интенсивности от тусклого звездного света до яркого дня на пляже, говорит Фланнери из Калифорнийского университета в Беркли. И большинство людей могут видеть радугу цветов благодаря естественным светособирающим белкам колбочек. Но активируемые светом молекулы, используемые в оптогенетике, гораздо более ограничены; они не так чувствительны к разным степеням яркости и обнаруживают только определенные длины волн и, следовательно, цвета света.«Это немного похоже на велосипед с одной передачей по сравнению с велосипедом с 20 передачами», - говорит Фланнери. Нынешние молекулы, добавляет он, не очень хорошо работают в сумерках.
Сотрудник Фланнери Эхуд Исакофф, нейробиолог из Калифорнийского университета в Беркли, входит в число исследователей, разрабатывающих активируемые светом молекулы, которые должны быть более гибкими, чем канальный родопсин и другие белки, заимствованные у микробов.
В декабре Флэннери и его сотрудники сообщили в Proceedings of the National Academy of Sciences, что они протестировали активируемую светом версию белка, называемого ионотрофным рецептором глутамата. В биполярных и других клетках, когда коммуникационное химическое вещество глутамат соединяется с рецептором, открывается канал, и ионы поступают в клетку. Исследователи соединили рецепторный белок с молекулой, называемой фотопереключателем. В темноте фотопереключатель удерживает глутамат подальше от стыковочного порта. Но когда синий свет попадает на искусственный рецептор, называемый LiGluR, фотопереключатель позволяет глутамату стыковаться и открывать канал.
Помещение белка LiGluR либо в ганглиозные клетки сетчатки, либо в биполярные клетки ON слепых мышей восстановило зрение грызунов. Мыши могли видеть достаточно хорошо, чтобы прятаться в тени, если их поместить в ярко освещенное место. Они также могли перемещаться по водному лабиринту.
Flannery, Isacoff и коллеги из Пенсильванского университета также вставили белок LiGluR в ганглиозные клетки сетчатки слепых собак. Клетки стали реагировать на свет, но команда все еще проверяет, помогает ли терапия собакам видеть.
LiGluR имеет свои плюсы и минусы, говорит Исакофф. Для этого требуется постоянный запас химического фотопереключателя, что, вероятно, будет означать еженедельные инъекции в глаза. С положительной стороны, пациенты могут получать обновления по мере улучшения фотопереключателя без необходимости дополнительной генной терапии. И если оптогенетическое зрение окажется сбивающим с толку или неудобным для пациентов, врачи могут просто прекратить вводить химическое вещество. Другие оптогенетические молекулы не имеют такого выключателя, говорит Исакофф.
Поскольку современные оптогенетические белки реагируют только на определенные длины волн света, люди, проходящие оптогенетическую терапию, вероятно, будут видеть в оттенках серого. Пан и другие модифицируют молекулы, чтобы расширить диапазон длин волн, чтобы восстановить некоторое цветовое зрение. Пан говорит, что до этой цели еще далеко.
Даже при наличии улучшенных светочувствительных молекул людям, получающим оптогенетическую терапию, вероятно, потребуется дополнительная помощь. Для повышения уровня окружающего света и настройки длины волны для оптимальной активации белков могут потребоваться специальные очки.
Мозг, вероятно, тоже нуждается в некоторой тренировке. «Мы даем сетчатке новый язык, и потребуется время, чтобы выучить его», - говорит Рошка.
Фрэнсис из RetroSense не беспокоится о том, что пациенты не смогут понять, что они видят. «Мозг очень хорошо адаптируется к зрительным данным и осмысливает эти изображения», - говорит он. По крайней мере, так было с людьми, которым имплантировали электроды в ганглиозные клетки сетчатки.
Те ранние эксперименты с электродами, которые показывали слепому тусклую свечу, в конце концов превратились в имплантаты сетчатки. В прошлом году компания Second Sight Medical Products of Sylmar, Калифорния, начала продавать свой «бионический глаз» в Соединенных Штатах. В устройстве используется 60 электродов, каждый из которых стимулирует несколько ганглиозных клеток сетчатки. Этого достаточно, чтобы незрячие могли ориентироваться и разглядеть окна и двери. Некоторые говорят, что могут видеть столы на своем пути и даже посуду на столе. Это значительное улучшение, говорит Сахель, но оно далеко от нормального зрения.
Частичная реставрация
Исследователи-оптогенетики считают, что могут добиться большего. В сетчатке насчитывается около 1 миллиона ганглиозных клеток и 10 миллионов биполярных клеток. Если хотя бы 10 процентов этих клеток можно сделать светочувствительными, это потенциально огромный выигрыш в разрешении по сравнению с имплантатами. Конечно, никто не знает, действительно ли чем больше сигнал, тем лучше. Это может просто усилить шум, который мозг должен расшифровать.
Даже если все идет гладко, пациенты не должны ожидать идеального зрения, говорит Сахель. «Он не достигнет сложности нормального зрения. Это частичное восстановление».
Исследователи быстро, но осторожно продвигаются к испытанию терапии на людях.
Тесты на безопасность на приматах пока выглядят многообещающе, но у исследователей нет окончательных результатов, и они не могут перейти к испытаниям на людях, пока не узнают, что это безопасно. «Мы хотим быть первыми, но мы хотим быть первыми, чтобы все делать правильно», - говорит Сахель.
Не боится темноты

Когда Эллисон Корона (справа) и ее друзья играли в карточную игру Uno, у них было правило, согласно которому зеленый и синий цвета были одного цвета. Правило было введено, потому что у 23-летнего Короны наследственная форма слепоты, называемая врожденным амаврозом Лебера.
Светособирающие клетки ее сетчатки не работают должным образом из-за мутации в гене под названием RPE65. В результате мир Corona был нечетким. Днем она могла видеть свет, но не тени. Она видела цвета, но с трудом различала их. После захода солнца мир погрузился во тьму. Корона боялась планировать занятия в колледже после 15:00. потому что она не могла ориентироваться в незнакомом окружении в одиночку.
Но у Короны есть одно из немногих заболеваний, которые врачи могут лечить с помощью традиционной генной терапии. В 2012 году она участвовала в клинических испытаниях в Пенсильванском университете, в ходе которых врачи вводили ей в глаза вирусы, несущие здоровые копии гена RPE65. Вирусы доставили ген в клетки сетчатки, где он создает нормальную версию белка, которого в противном случае не хватает Corona.
Вскоре после операции ее зрение изменилось. Сначала свет был ошеломляющим и болезненным.
«Я просто сидел в темноте», - говорит Корона. «Я везде носил солнцезащитные очки. Я был похож на рэпера».
Но она приспособилась, и ее зрение значительно улучшилось, хотя по закону она все еще слепа.
Сегодня она играет в Уно без правила зеленый-синий. Но больше всего ей нравится ночное видение. «Теперь страх - это не вещь, - говорит она. «Я могу передвигаться ночью. Это большое достижение».
Несмотря на недавние сообщения о том, что люди с LCA в конечном итоге теряют чувствительность к свету, Джин Беннетт, молекулярный генетик из Университета Пенсильвании, которая помогла провести исследование, в котором участвовала Корона, говорит, что ее ранние данные указывают на то, что улучшения будут продолжаться. - Тина Хесман Сай
Эта статья опубликована в выпуске от 30 мая 2015 года с заголовком «Видение света: преобразование нервных клеток в фоторецепторы для восстановления зрения».
