Трехмерная биопечать недавно сделала новый шаг вперед, когда в январе в журнале Nature Communications была опубликована статья под названием «Непривязанное микро-роботизированное кодирование трехмерного состава материала». Исследователи из Brigham and Women’s Hospital и Университета Карнеги-Меллона объединились для разработки метода 3D-печати биологического материала с использованием роботов с магнитным управлением.
Команда состояла из доктора BWH из BWH. Саваш Тасоглу, научный сотрудник отдела почечной медицины, и д-р Уткан Демирджи, доцент медицины отдела биомедицинской инженерии, вместе с докторами. Эрик Диллер и Метин Ситти, профессор кафедры машиностроения Университета Карнеги-Меллона. Используя то, что исследователи называют «непривязанным кодированием микророботов», они смогли дистанционно управлять небольшими роботами, используя магнитные поля, для перемещения гидрогелей, содержащих биологический материал, для формирования определенных структур. Магнитная работа этих микророботов использовалась для того, чтобы строительство объектов могло выполняться без нарушения жизнеспособности и пролиферации биологических клеток.
Чтобы продемонстрировать многие возможности своей техники, исследователи провели ряд экспериментов, таких как расположение треугольников и стержней:

“Микророботизированное кодирование квадрата (a – f) кремниевые чиплеты в квадратные и стержневые структуры, а (g – l) гексагональные полидиметилсилоксановые блоки в треугольник и узоры стержней. Все эксперименты проводились в камере размером 20 мм × 20 мм × 4 мм. Снимки манипуляций с квадратными кремниевыми чиплетами 1 мм × 1 мм в разные моменты времени (показаны в левом углу). Формат метки времени: минуты:секунды. Магнитные микророботы показаны синим кружком (a – f). Черный объект на каждом изображении (g – l) - вид сверху на ползущую магнитную микро -робот. Масштабная линейка, 1 мм.
И строительство пирамидальной структуры, состоящей из гидрогелевых структур и микрокомпонентов различной формы, таких как медные цилиндры диаметром 100 мкм и полистироловые сферы диаметром 200 мкм:
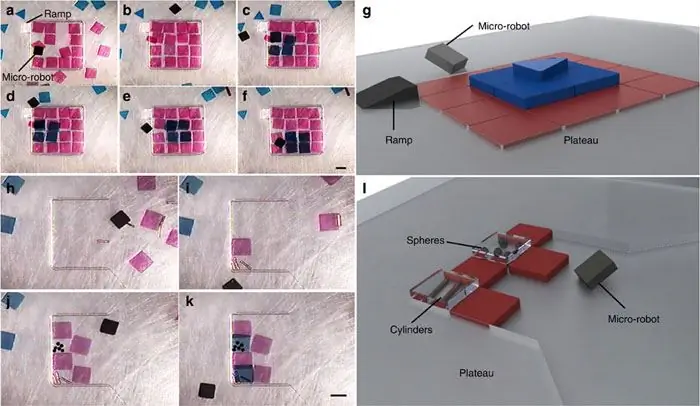
Микроробот, создающий (a – g) тройку -слоистая неоднородная пирамидальная структура, состоящая из 16, 4 и 1 геля на каждом слое, и (h – l) гетерогенная структура, состоящая из гидрогелей поли(этиленгликоль) диметакрилата (ПЭГ), которые полностью заключают в себе медные цилиндры диаметром 100 мкм и полистироловые сферы диаметром 200 мкм. Все эксперименты проводились в камере 20 мм × 20 мм × 4 мм в фосфатно-солевом буфере (PBS). Моментальные снимки этапов манипуляции показаны на каждом подрисунке, а завершенная структура показана в схематической форме в (g ) и (l ), соответствующие панелям (e ) и (k ), соответственно. Гели помещали на второй слой, перемещая их по полиэфирному плато, которое имеет такую же толщину, как и первый слой гелей. Третий слой был достигнут в (d ) путем проталкивания гелей вверх по полиэфирной рампе. Временные точки изображений: 2:45 (a ), 12:48 (b ), 19:24 (c ), 21:19 (d ), 22:28 ( e ), 25:22 (f ), 0:00 ( h ), 3:40 (i ), 13:36 (j ) и 15:39 (k) в формате минуты:секунды. Масштабная линейка, 1 мм.
И сборка фигур с использованием стволовых клеток мыши:
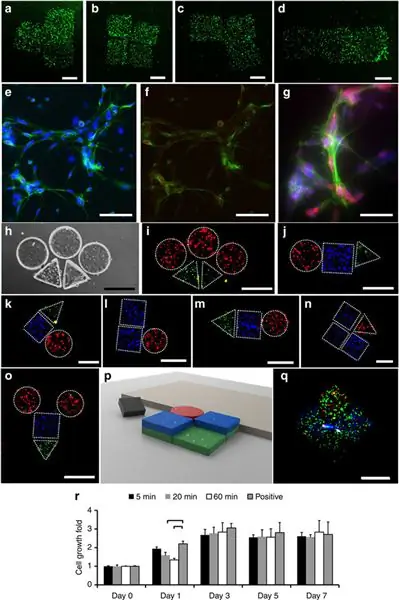
Флуоресцентные изображения Национальных институтов здравоохранения (NIH) 3T3 мышиных эмбриональных фибробластов, инкапсулирующих гидрогели после сборки (a) T- формы, (b) квадратной формы, (c) L-образной формы и (d ) стержнеобразные конструкции. Масштабная линейка, 500 мкм для (a –d ). Зеленый представляет собой живые клетки, а красный представляет мертвые клетки. (e –g ) Иммуноцитохимия пролиферирующих клеток, окрашенных Ki67 (красный), DAPI (синий) и фаллоидин (зеленый) на 4-й день. (e ) Клетки, окрашенные DAPI и фаллоидином при увеличении × 20. Масштабная линейка, 100 мкм. (f ) Клетки, окрашенные Ki67 и фаллоидином при увеличении × 20. Масштабная линейка, 100 мкм. (g ) Клетки, окрашенные Ki67, DAPI и фаллоидином при увеличении × 40. Масштабная линейка, 40 мкм. (a –g ) Окрашивание выполняли после сборки гидрогелей.(h –q ) Двух- и трехмерные гетерогенные сборки эндотелия пупочной вены человека клетки, 3T3 и гидрогели, инкапсулирующие кардиомиоциты. HUVEC, 3T3 и кардиомиоциты окрашиваются Alexa 488 (зеленый), DAPI (синий) и иодидом пропидия (красный) соответственно. (h ) Светлопольные и (i ) флуоресцентные изображения сборки, состоящей из круглых и треугольные гели. (j –o ) Флуоресцентные изображения нескольких двумерных гетерогенных сборок HUVEC, 3T3 и гидрогели, инкапсулирующие кардиомиоциты. (p ) Схематическая форма и (q ) флуоресцентное изображение трехмерной гетерогенной сборки HUVEC, 3T3 и гидрогели, инкапсулирующие кардиомиоциты. Масштабная линейка, 500 мкм для (h –q ). Окрашивание проводили перед сборкой гидрогелей для (h –q ). Длительность дистанционной сборки (a –d, h –q ) составляет от ~10 с до 5 мин в зависимости от сложности окончательной формы.(r) MTT (3-(4,5-диметилтиазол-2-ил)-2, 5-дифенилтетразолия бромид, желтый тетразол) результаты анализа 3T3 клеточные суспензии, в которых микророботы находились в течение 5, 20 и 60 мин. Положительный контроль представляет собой клетки, которые инкубировали без присутствия микроробота. Результаты нормализованы по значениям поглощения в день 0. Статистический анализ проводился только между положительным контролем и случаями (5, 20, 60) минут. Скобки, соединяющие группы, указывают на статистически значимое различие (n=6, P<0.05). Столбики погрешностей представляют собой стандартную ошибку среднего.
Они также играли в тетрис, чтобы показать, насколько они могут быть точными:

Микророботизированное кодирование и реконфигурация гидрогелей диметакрилата полиэтиленгликоля (a – k) и желатинметакрилатные гидрогели (l – t) с различных форм в сложные плоские конструкции. Черный объект на каждом изображении - это ползающий микроробот, вид сверху. Чтобы продемонстрировать точность манипуляций с микророботами, были закодированы гели нескольких форм, включая квадрат, треугольник, круг, шестиугольник, форму скобки, форму плюса и другие. Все эксперименты проводились в камере 20 мм × 20 мм × 4 мм в фосфатно-солевом буфере (PBS). Последовательности непрерывного кодирования и перенастройки показаны на панелях (a – f), (g, h ), (j, k ), (l –p) и (r – t). Ориентация и контроль положения в непривязанном микророботизированном кодировании состава материала (u – y). Снимки гидрогелей ПЭГ в форме тетриса в прямоугольном резервуаре в разные моменты времени: 2:08 (u), 8:32 (v ), 16:12 (w ), 31:39 (x), 48:00 (y) в формате минуты:секунды. Ориентация и положение поступающих гидрогелей динамически изменялись по мере динамического изменения геометрии полостей. Все эксперименты проводились в камере размером 20 мм × 20 мм × 4 мм. Масштабная линейка, 1 мм.
Доктор. Тасоглу объясняет: «По сравнению с более ранними методами, эта технология обеспечивает реальный контроль над тканевой инженерией снизу вверх. Их подход к использованию микроботов - это только начало исследований группы, но Метин Ситти из CMU надеется, что их техника изменит область 3D-биопечати, заявив: «Наша работа произведет революцию в точной трехмерной сборке сложных и гетерогенных зданий тканевой инженерии. блоков и служат для повышения сложности и понимания систем тканевой инженерии».

