Экзотический углерод нарушает фундаментальное правило химии
Вы узнаете в школе: Carbon имеет максимум четыре партнера по связям. Но это не всегда так - некоторые экзотические молекулы нарушают правило.

Органическая химия основана на фундаментальных знаниях о том, что углерод всегда образует ровно четыре связи электронной пары. В течение десятилетий химики испытывали все большее искушение найти исключения из этого железного закона, то есть молекулу, в которой углерод связан с пятью или даже шестью другими атомами. В ноябре 2016 года Конрад Зеппельт и его студент Мориц Малишевски из Свободного университета Берлина описали такой святой Грааль в этой области исследований: они успешно выделили дикатион гексаметилбензола, в котором атом углерода окружен в общей сложности шестью партнерами по связыванию.
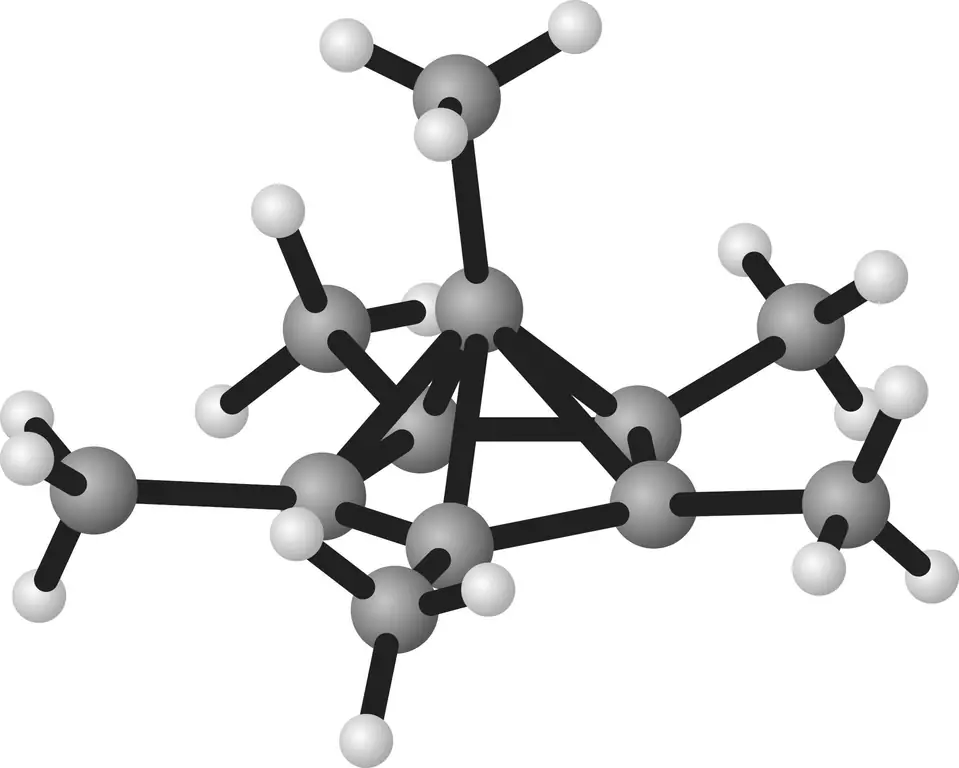
Голландский химик Хепке Хогевен еще в начале 1970-х годов предсказал соответствующую структуру пятисторонней пирамиды. Согласно его теории, шестичленное углеродное кольцо бензола должно сжиматься до пятичленного кольца при потере двух электронов, при этом шестой атом кольца образует краеугольный камень пирамиды. В 1973 году спектроскопические измерения дали первые указания на то, что его гипотеза верна. Но прошло еще 43 года, прежде чем Малишевский и Сеппельт произвели достаточное количество вещества, чтобы вырастить кристаллы и использовать их для ясной демонстрации любопытной молекулярной структуры с помощью рентгеновского анализа..
Ароматическая пирамида
Родить по этой причине старые учебники химии было бы преждевременно, ведь шестикратно связанный углерод тоже строго придерживается установленных правил, как поясняет Малишевский: «Атом углерода на вершине пирамиды шестикоординирован, но не шестивалентный, а четырехвалентный как обычно. Это означает, что перед шестью партнерами по соединению стоят не шесть связей электронных пар, а только четыре, как всегда.
Как показали квантово-механические расчеты Хогевена еще в 1970-х годах, пирамидальная структура не только возможна, но и возникает автоматически - и это несмотря на необычный атом углерода. На самом деле перегруппировка - это единственный способ для молекулы сохранить свой «ароматический» характер с шестью электронами, распределенными по кольцу. Однако после этого, в отличие от классических ароматических соединений, таких как бензол, система уже не находится в одной плоскости: атом на вершине пирамиды также участвует в секстете электронов. Вместе с классической связью с метильной группой это дает требуемые восемь электронов (правило октетов) четырех электронных парных связей углерода.
На самом деле, все попытки создать углерод с более чем восемью связывающими электронами потерпели неудачу. Но даже не столь амбициозная цель получить как минимум больше, чем четыре возможных партнера по связыванию согласно правилу октетов, оказалась настоящей геркулесовой задачей. Первопроходцем был Джордж Олах, впоследствии лауреат Нобелевской премии по химии, которому в 1960-х годах удалось протонировать углеводороды, то есть присоединить дополнительный положительно заряженный атом водорода к метану и родственным соединениям.
Для этого он использовал вещества почти такие же экзотические, как и сам пятисвязный углерод: так называемые суперкислоты, по сравнению с которыми почти все остальное выступает в качестве основания. Продукты реакции, которые относятся к сильнейшим кислотам, соответственно неустойчивы, поэтому их нельзя выделить и определить их строение. Однако решающий прорыв, наконец, пришел с другого направления - и с ним начался двухдесятилетний спор.
Любопытные молекулы с завода по производству бомб
Углерод с более чем четырьмя партнерами по связыванию был известен уже несколько лет во время экспериментов Олаха. Еще в 1963 году рабочие группы производителей боеприпасов и топлива открыли карбораны: икосаэдрические атомные группы из бора и водорода, содержащие два атома углерода. В них каждый атом бора и каждый атом углерода в клетке имеет шесть связующих партнеров.
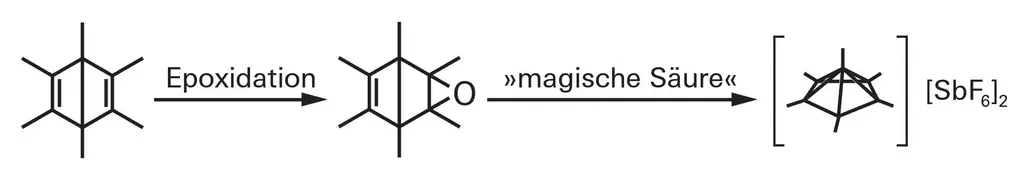
Приготовление дикатиона гексаметилбензола так же необычно, как и его структура. Отправной точкой является вариант Dewarbenzene, снабженный шестью метильными группами, химический раритет с той же молекулярной формулой, что и бензол, но с другой структурой. Сеппельт и Малишевский растворили его эпоксид в «волшебной кислоте», смеси фтористоводородной кислоты и пятифтористой сурьмы, которая является одной из самых сильных кислот. Затем кислород исчезает из молекулы в виде O2-. Образуется дважды положительно заряженный гексаметилбензол, но он уже не содержит бензольного кольца: атомы самопроизвольно перегруппировались. Вещество образует с гексафторидом сурьмы соль, кристаллы которой устойчивы при низких температурах и в отсутствие кислорода.
Чтобы понять, как работает связывание, подумайте о дикатионе гексаметилбензола как о сложной молекуле. Одна часть представляет собой отрицательно заряженное пятичленное кольцо с пятью метильными группами - молекула, хорошо известная в органической химии и обозначаемая для краткости Cp. Анион Cp напоминает бензольное кольцо; таким образом, он несет шесть электронов, размазанных по кольцу, и поэтому является ароматическим. С другой стороны находится молекула этана, в которой отсутствуют три атома водорода и связанные с ними пары электронов на одном из двух атомов углерода, поэтому она имеет три положительных заряда. Когда эту ампутированную молекулу помещают в кольцо вертикально положительным концом вперед, шесть электронов в кольце связывают кольцо с вершиной пирамиды.
Как ни парадоксально, большое количество связей возникает из-за того, что в молекуле особенно мало электронов. У бора осталось только три электрона, но, как и углерод, он в принципе может образовывать четыре связи. Поэтому в соединениях элемента наблюдается хронический недостаток электронов. Эти обстоятельства делают возможным особый тип привязки - многоцентровую привязку. Здесь электроны располагаются не парами между двумя атомными ядрами, как это обычно бывает в органической химии, а каждая пара электронов обслуживает одновременно несколько атомных связей. Атомы углерода также входят в состав карборанов.
Этого не происходит в обычных органических молекулах - для этого в углероде слишком много электронов. Однако с 1940-х годов эксперты подозревали, что некоторые положительно заряженные органические соединения нарушают это правило. Соответственно, они также образуют многоцентровые связи и содержат пяти- и шестикратно связанные атомы углерода. Поэтому их называют неклассическими ионами.
Священная война странных уз
Однако в 1961 году будущий лауреат Нобелевской премии Герберт Браун обвинил сторонников гипотезы в игнорировании доказательств, указывающих на классические механизмы, такие как быстро меняющиеся связи. Другая сторона, включая Джорджа Олаха, сопротивлялась. Результатом стало то, что Браун назвал «священной войной» за неклассические ионы, которая продолжалась вплоть до 1980-х годов.
Благодаря все более и более современным методам анализа, появлялось все больше доказательств того, что неклассическая интерпретация верна. Строгих доказательств экспертам пришлось ждать до 2013 года. В том же году рабочая группа под руководством Инго Кроссинга из Фрайбургского университета ясно продемонстрировала давно вызывающий споры атом углерода с пятью связями в так называемом норборнильном катионе. Результат вдохновил их повторить подвиг с шестикратно связанным углеродом, пишут Сеппельт и Малишевски в своей текущей публикации о дикатионе гексаметилбензола в «Angewandte Chemie».
Два ученых теперь замыкают петлю на карборанах, которые предоставили первое указание на эту нетипичную форму связи в углероде. Ситуация связывания в пирамидальном гексаметилбензольном дикатионе удивительно похожа на ситуацию в икосаэдрических кластерах бора. Каким бы необычным ни был химический состав таких неклассических молекул, Малишевский подчеркивает, что правило октета строго соблюдается даже в случае углерода с шестью партнерами по связыванию. Но бензольное кольцо, перестроенное в пирамиду с экзотической многоцентровой связью, выглядит достаточно эффектно.