Введение в свойства углеродных нанотрубок
Углеродные атомы могут связываться со своими соседними атомами для создания листов (графена), цилиндров (нанотрубок) и шаров (фуллеренов) с уникальными свойствами. В этой статье содержится минимальная информация, необходимая для электротехники для анализа научной статьи об одностенных углеродных нанотрубках.
Заметка об информации, представленной в этой статье: в целях обеспечения того, чтобы статья была максимально удобна для читателей для электротехнической аудитории, я принял определенные свободы, к которым может возразить продвинутый читатель. Пожалуйста, не стесняйтесь преодолевать любые пробелы, которые, по вашему мнению, я оставил читателю в комментариях ниже.
Цель и введение
С момента их открытия в 1991 году ученые изучали химические, физические и материальные свойства углеродных нанотрубок. В 1998 году появились первые полевые транзисторы, и к 2003 году NEC использовала их для создания транзисторов с на порядок большей проводимостью, чем кремниевые МОП-транзисторы. В 2013 году ученым удалось создать функционирующий 20-процессорный углеродный нанотрубный компьютер.
В этой статье делается попытка предоставить справочную информацию, необходимую для лучшего понимания того, какие нанотрубки и терминология используется для их описания, чтобы вы могли обратиться к научным статьям, которые вас интересуют. В этой статье предполагается, что читатель не принял физическую химию или физику конденсированных сред.
Для получения дополнительной информации обратитесь к нашему учебнику:
- Том III, глава 2 - Полупроводники
- Том III, глава 3 - Валантность и кристаллы
- Том III, глава 4-Полосная теория твердых тел
На этом веб-сайте также есть некоторые высококачественные визуализации: //toutestquantique.fr/en/
Строительные блоки
Химия углеродных атомов
Нейтральные атомы углерода имеют шесть электронов, которые окружают ядро и удерживаются в атоме электрической силой. Электроны, далекие от ядра, требуют меньше энергии меньше энергии, чем электроны, которые лежат близко к ядру.
Поскольку для удаления самых внешних электронов требуется меньше энергии, неудивительно, что самые внешние электроны (валентные электроны) являются теми, которые взаимодействуют с другими атомами.
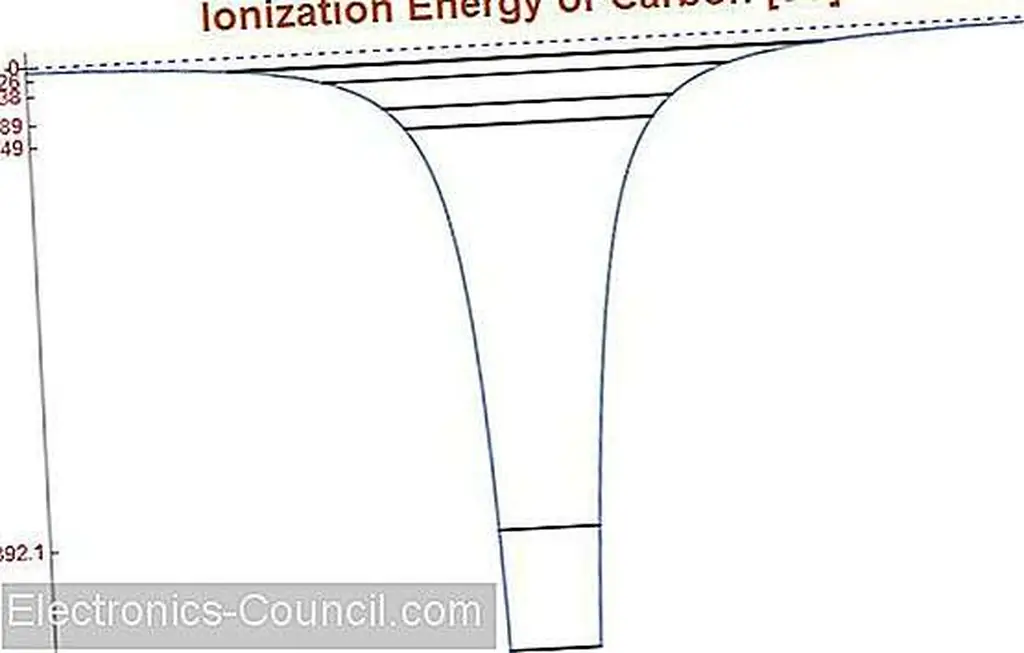
Электроны, которые ближе к ядру, должны постепенно получать большее количество энергии, чтобы иметь возможность покидать свой родительский атом, создавая ион. Данные от Wolfram Alpha
Квантовая теория
Электроны движутся в уникальных повторяющихся образцах в области пространства вне ядра атома на орбиталях, которые могут быть описаны и предсказаны с помощью математических волновых функций, которые определяются уникальными свойствами отдельных электронов. Каждая орбита может быть занята одним электроном, и каждая орбита имеет определенное количество энергии, связанной с ней - два электрона никогда не занимают одну и ту же орбиталь, но могут иметь одинаковые энергии. Электроны должны поглощать энергию, чтобы иметь возможность двигаться на высшую орбиталь, и если они поглощают достаточно энергии, они могут полностью покинуть атом. Электроны склонны к спонтанному движению на более низкие энергетические орбитали, если для них доступно пространство, и, как и они, они будут вытеснять дополнительную энергию как фотон, т. Е. Частицу электромагнитной энергии (которая иногда является видимым светом).
Электроны находятся в области пространства, которая определяет их специфические орбитали, никогда между ними, факт, частично подтвержденный исследованием спектра излучения углерода. Эти спектральные линии соответствуют фотонам, которые имеют энергию, равную разности энергий двух орбиталей.
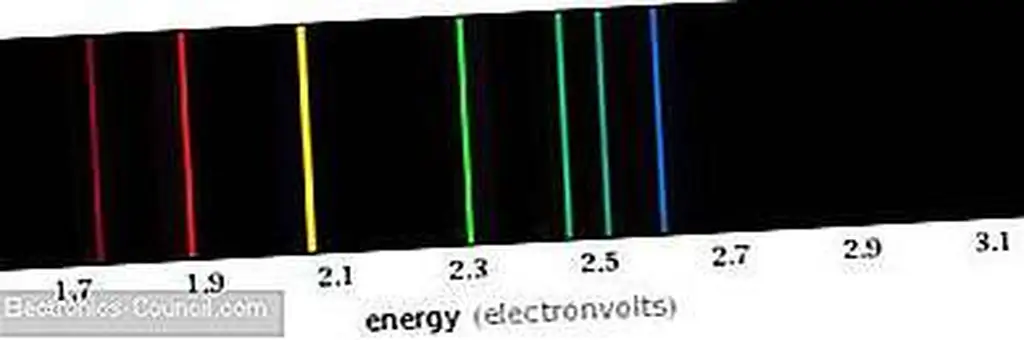
Видимый спектр выбросов углерода. Фотоны определенной длины волны испускаются, когда электроны движутся к более низким энергетическим орбиталям атомов углерода. Изображение предоставлено Wolfram Alpha
В самой низкой энергетической конфигурации углерода два электрона заполняют ближайшую к ядру орбиту 1s, два электрона заполняют орбиту 2s, а остальные два электрона заполняют орбиту 2p. Самые удаленные четыре электрона доступны для связи с другими атомами углерода. Поглощая небольшое количество энергии, изменяются волновые функции и формируются новые гибридные орбитали.
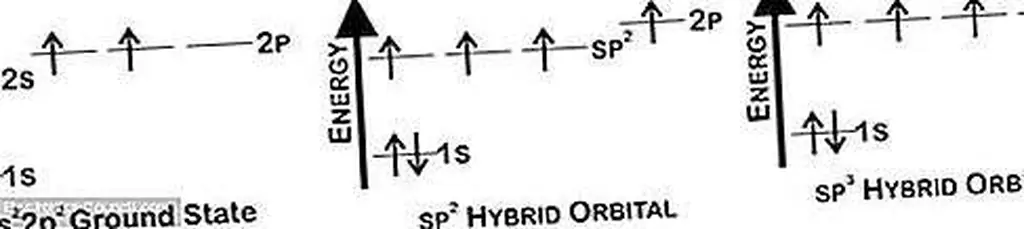
Электронные диаграммы энергии для основных состояний, sp 2 и sp 3 гибридных орбиталей. Сначала электроны заполняют самые низкие энергетические орбитали. Но с добавлением небольших количеств энергии (~ 1-2 эВ) электроны могут двигаться, чтобы создать гибридизованные орбитали, когда слияния 2s и 2p-орбиталей сливаются
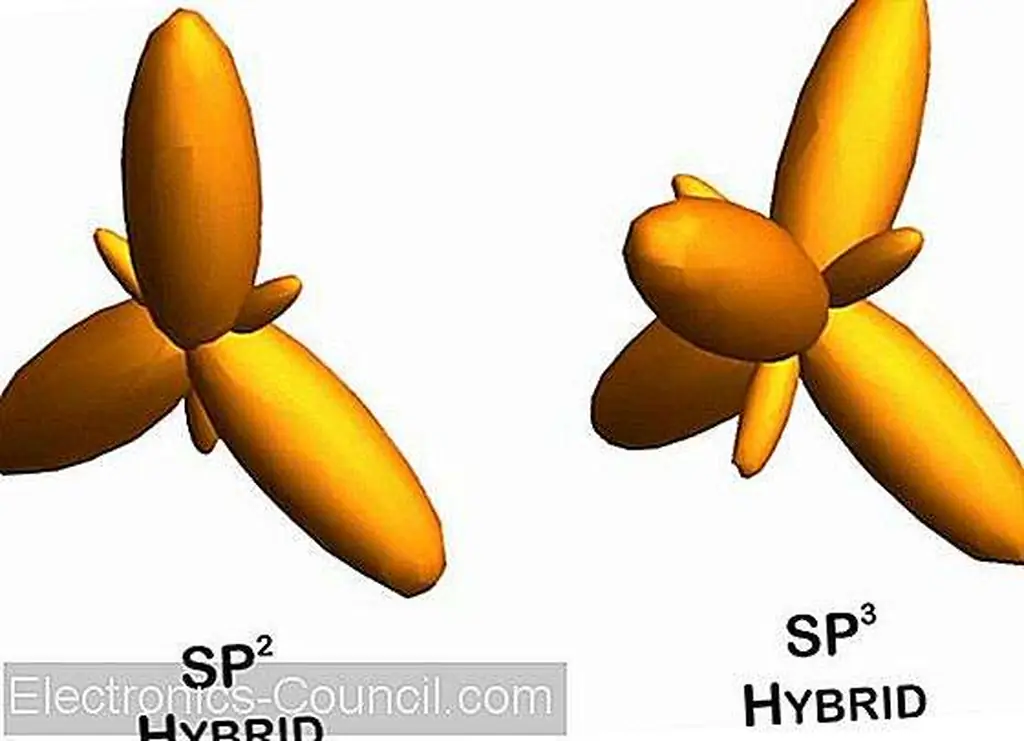
3D-гибридные орбитальные модели. Обратите внимание на тригональные плоские и sp 3 трехгранные формы sp 2. Изображение от Марка Хьюза
Углерод-углеродные облигации
Углеродные атомы могут связываться с тремя или четырьмя соседними атомами для создания аллотропов углерода с уникальными свойствами материала.
Атом углерода может связывать:
- С ближайшими четырьмя атомами углерода в тетраэдрической структуре (sp 3- гибридная орбиталь) для создания алмаза 3D-кристаллической структуры
- С тремя ближайшими атомами углерода в тригональном планарном узоре (sp 2 гибридная орбиталь) для создания структуры кристалла 2D-решетки графена
- С тремя ближайшими атомами углерода в новой форме (sp 2 и sp 3 смешанного состояния) для создания q-углерода, нанотрубок и фуллеренов
Два нейтральных атома углерода, разделенные несколькими атомными ширинками, будут иметь одинаковые уровни энергии и впоследствии идентичные спектральные линии. Когда они приближаются близко друг к другу, электроны начинают влиять друг на друга, так как их орбитальные волновые функции начинают перекрываться.
Поскольку атомы углерода связаны друг с другом в кристалле, большее количество электронов перемещается между атомами, подчиняясь правилу, что электрон может идти только по пути, который не вызывает разрушительной интерференции, и только один электрон может существовать на определенной орбите за один раз. S-орбитали расщепляются на вдвое больше орбиталей, чем атомы (по одному для каждого электрона в S-орбиталях), некоторые с более высокой энергией и некоторые с более низкой энергией, чем раньше. Р-орбитали расщепляются в шесть раз больше орбиталей (Px, Py, Pz), так как есть атомы, опять же некоторые с более высокой энергией, а некоторые с более низкой энергией.
Дополнительные орбиты, которые подчиняются правилам, что два электрона не могут находиться в одной орбитальной и разрушительной интерференции, не могут возникнуть, могут возникнуть. Распространение энергии этих новых орбиталей составляет порядка нескольких электрон-вольт и обратно связано с расстоянием между атомами. Учитывая, что в одной моле имеется 10 23 атома, в одной только 1-й оболочке имеется 10 23 энергетических уровня, которые обладают единственными энергиями в диапазоне 10 0 эВ; что оставляет невообразимо большое количество уникальных энергий, плотно упакованных в небольшой диапазон.
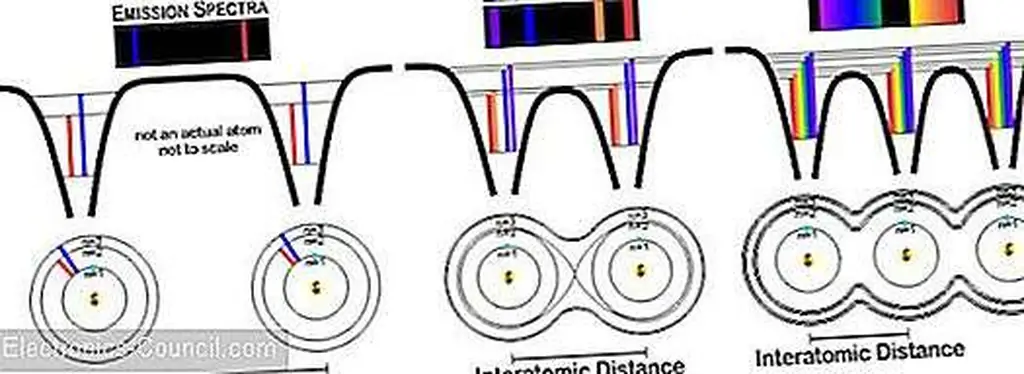
Художественная интерпретация увеличенных спектральных линий в качестве дополнительных атомов углерода приближается друг к другу. Электроны существуют только в разрешенных зонах энергии. В запрещенных полосах между разрешенными полосами нет электронов. Изображение от Марка Хьюза
То, что начинается с дискретных уровней энергии отдельных атомов, быстро расширяется в энергетические зоны, поскольку несколько атомов связаны друг с другом. Пространство между полосами, где не разрешены электроны, называется запрещенной зоной. Невозможно и необязательно идентифицировать отдельные электронные орбитали, когда они настолько плотно разнесены.
Диапазон валентности и зона проводимости
Материал может получить энергию только в том случае, если это количество, необходимое для перехода от одной энергетической зоны к соседней полосе с пустым энергетическим уровнем. Если полоса, содержащая валентные электроны, заполнена (или количество введенной энергии меньше, чем необходимо для перемещения между полосами), материал будет действовать как изолятор. Если полоса, содержащая валентные электроны, имеет столько доступных уровней, что она не может быть заполнена, материал действует как проводник.
Электроны могут получать энергию для перемещения между полосами посредством приложения внешнего электрического поля, поглощения фотона или тепловой энергии при температурах выше абсолютного нуля. Если ширина запрещенной зоны (~ 10 0 эВ), тепловой энергии достаточно, чтобы позволить электронам спонтанно перейти в более высокую энергетическую зону, давая материал свойствам полупроводника. Почти заполненная полоса, которую покидают электроны, называется валентной зоной, а почти пустая полоса, которую они прыгают, называется зоной проводимости.
Если между валентной зоной и зоной проводимости существует большой разрыв, электроны не могут свободно перемещаться между энергетическими зонами, а материал является изолятором. Если уровни энергии расширяются и запретная зона отсутствует (перекрытие валентности и зоны проводимости), материал действует как металл. Если зазор мал, но все еще присутствует, он функционирует как полупроводник.
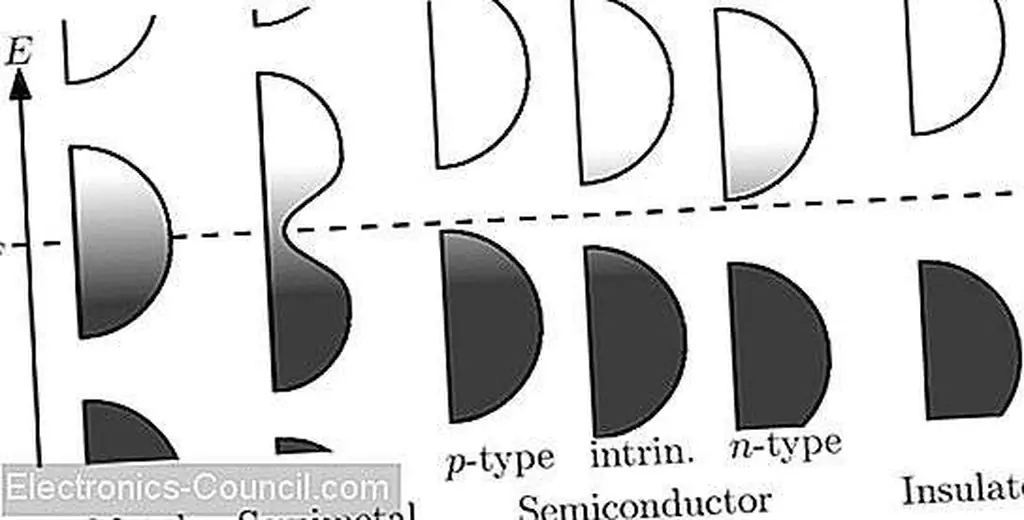
Изображение, показывающее полосы валентности и проводимости родовых материалов. Изображение создано Nanite
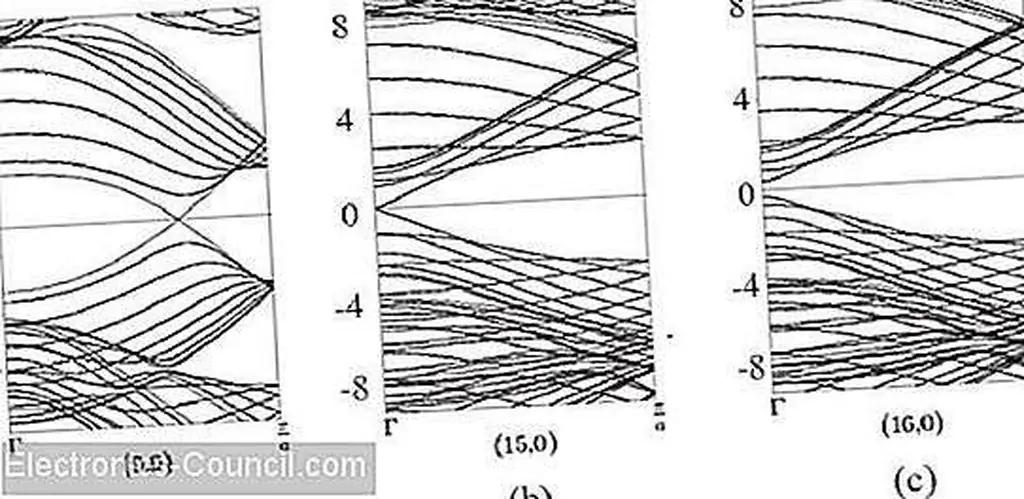
Графики структуры сгибающейся зоны зоны нанотрубок с одной стенкой: (а) металл (перекрывающиеся орбитали), (б) полуметалл (небольшое перекрытие) и (в) полупроводник (небольшой зазор). Изображение предоставлено InTechOpen
Графен в нанотруб
Листы графена представляют собой двумерные, сотообразные массивы атомов углерода с каждым атомом углерода, связанным с тремя соседними атомами в повторяющейся гексагональной матрице.
Начните с любого заданного атома углерода в гексагональном расположении (например, верхнем центре), и вы можете перемещать (n, m) единицы, чтобы найти другой атом углерода с одинаковой геометрией в гексагональной компоновке (например, верхний центр). Двигайтесь вправо по зигзагообразному рисунку, и вы найдете идентичное расположение атомов углерода, которое увеличивается только с индексом n. Переместите 30 ° вниз и вправо по шаблону кресла, и вы снова найдете идентичное расположение атомов углерода, где n = m.
Расстояние и направление к первым повторениям называются решеточными векторами, а множители (n, m) - это индексы.
У атомов углерода в этой компоновке есть электроны в sp 2 гибридных орбиталях (плоский тригональ) с одним электроном на орбите 2p 1, диссоциированным от его родительского атома и свободно перемещающимся вокруг кристаллической решетки.
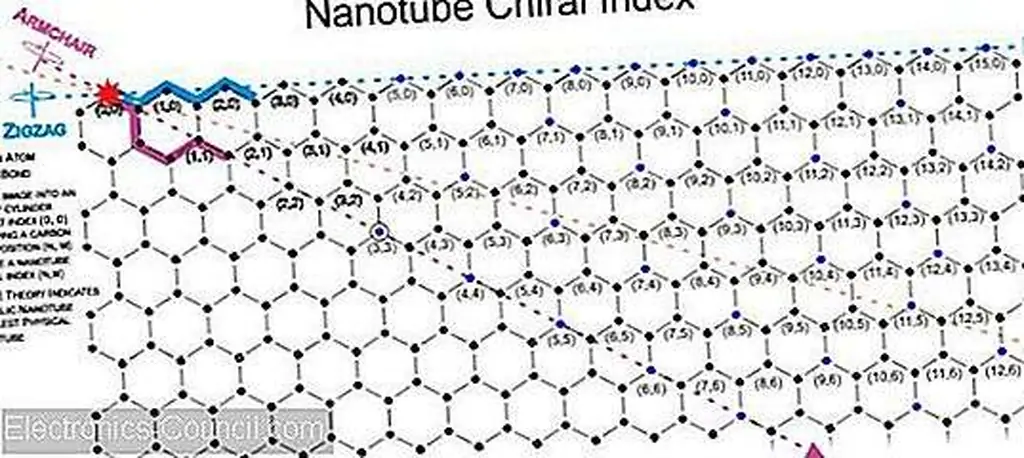
Изображение хирального индекса графенового листа от Марка Хьюза
Нанотрубки описываются их хиральным индексом (n, m). Представьте себе прокатку листа графена в цилиндр вокруг данной оси, чтобы один атом углерода отображался поверх другого атома углерода в положении (n, m). Это создает повторяющуюся картину атомов углерода, чьи электронные орбитали взаимодействуют. Он больше не является тригональной плоской формой sp 2, но это не совсем форма трехгранника sp 3. Орбиталы находятся в смешанной форме sp 2 -sp 3, но все еще с электроном, диссоциированным от исходного атома, который свободно перемещается между атомами.
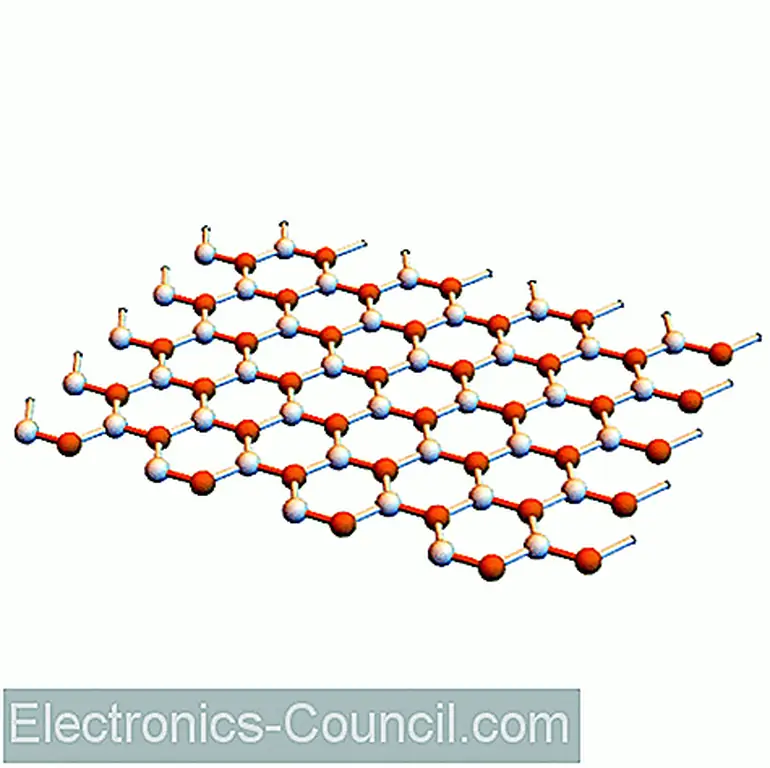
Вы можете визуализировать нанотрубку как свернутый лист графена. В качестве примера: Представьте, что вы катите изображение выше, чтобы сформировать цилиндр так, чтобы атом углерода в положении (0, 0) перекрывался и заменял атом углерода положением (6, 6); это будет описано как однослойная углеродная нанотрубка (6, 6).
Стоит отметить, что нанотрубки не изготавливаются путем прокатки графеновых листов. Это просто инструмент визуализации для описания групп нанотрубок и прогнозирования их свойств.
Свойства Nanotube
Электрон, который движется вокруг окружности нанотрубки, имеет другую волновую функцию, чем электрон, который движется вдоль длины трубки. Затем нанотрубка имеет различные характеристики по окружности, параллельной оси, и поперек оси.
| Теплопроводность | По длине | Через ось |
| Однослойная нанотрубка | $$ 3500 \ tfrac {W} {m \ cdot K} $$ | $$ 1, 5 \ tfrac {W} {m \ cdot K} $$ |
| медь | $$ 400 \ tfrac {W} {m \ cdot K} $$ | |
| алюминий | $$ 235 \ tfrac {W} {m \ cdot K} $$ | |
| Золото | $$ 320 \ tfrac {W} {m \ cdot K} $$ | |
Одностенные углеродные нанотрубки в ~ 10 раз более термически проводящие по длине, чем медь, алюминий или золото. В поперечном направлении по их оси они в 150-250 раз меньше теплопроводящих, чем медь, алюминий или золото
| Текущая плотность | По длине | Через ось |
| Однослойная нанотрубка | $$ 10 ^ 7-10 ^ {13} гидроразрыва {A}, {см ^ 2} $$ | незначительный |
| медь | $$ 5 \ times10 ^ 2-5 \ times10 ^ 3 \ гидроразрыва {А} {см ^ 2} $$ | |
Плотность тока углеродных нанотрубок на порядок выше, чем у меди
Подробнее о свойствах углеродных нанотрубок можно найти в книге « Физические свойства углеродных нанотрубок».
Приложения и выводы
Углеродные нанотрубки, вероятно, уже есть в вашем доме. Исследователи уже создали транзисторы, компьютеры, телевизоры и микробиологические микроскопы с углеродными нанотрубками.
Если вы в конце своей карьеры, маловероятно, что вы приобретете полупроводник из нанотрубок для включения в новый дизайн продукта. Но если вы являетесь инженером начального уровня или средней карьеры, вы сможете приобрести NRAM на основе нанотрубок от Fujitsu уже в 2018 году, и рынок должен продолжать расти оттуда.
Изображение предоставлено Нантеро
Эта статья избегала использования технических терминов, где это возможно, чтобы обратиться к более широкой аудитории. Некоторые технические термины, которые используются в отношении углеродных нанотрубок, можно найти, щелкнув ссылки, разбросанные по всей статье.

