Новаторский способ ученых Пенсильванского университета улучшить ночное зрение у взрослых с врожденной слепотой станет прорывом в офтальмологии: генная терапия.
Результаты нового метода были опубликованы в iScience 4 сентября.
Как заявил UPenn, у взрослых с генетической формой детской слепоты наблюдалось поразительное восстановление ночного зрения в течение нескольких дней после экспериментальной генной терапии, согласно исследователям Института глаза Шейе в Медицинской школе Перельмана. в Пенсильванском университете.
У пациентов был врожденный амавроз Лебера (LCA), врожденная слепота, вызванная мутациями гена GUCY2D. В соответствии с протоколом клинических испытаний, исследователи провели генную терапию AAV, которая несет ДНК здоровой версии гена, в сетчатку одного из глаз пациента.
У каждого пациента наблюдалось значительное улучшение зрительных функций, опосредованных фоторецепторными клетками палочковидного типа, в пролеченном глазу в течение нескольких дней после лечения. Большая часть способности человеческого глаза видеть при слабом освещении обеспечивается палочками, которые обладают невероятной светочувствительностью.
«Эти захватывающие результаты демонстрируют, что основной молекулярный механизм фототрансдукции остается в значительной степени неповрежденным в некоторых случаях LCA, и, таким образом, может поддаваться генной терапии даже после десятилетий слепоты», - сказал ведущий автор исследования Сэмюэл Г. Джейкобсон, доктор медицинских наук, профессор офтальмологии в Пенсильвании.

Почти 40 000 детей страдают
Один из каждых 40 000 новорожденных рождается с LCA, что является одним из наиболее распространенных врожденных состояний слепоты, говорит UPenn.
Степень потери зрения варьируется от одного пациента с LCA к другому, но все такие пациенты имеют серьезные нарушения зрения с младенчества.
LCA может быть вызван дисфункцией более двух десятков генов.
До 20 процентов случаев LCA вызваны мутациями в гене GUCY2D, который производит ключевой белок, необходимый для «каскада фототрансдукции», который преобразует свет в нервные сигналы в фоторецепторных клетках сетчатки.
Для двух пациентов, 19-летнего мужчины и 32-летней женщины, у которых были особенно тяжелые нарушения зрения на основе палочек, исследователи использовали более высокие дозы генной терапии.
Пациенты имели некоторое, хотя и сильное снижение, зрительные функции днем, ночью они были практически слепы, светочувствительность в 10 000-100 000 раз ниже нормы.
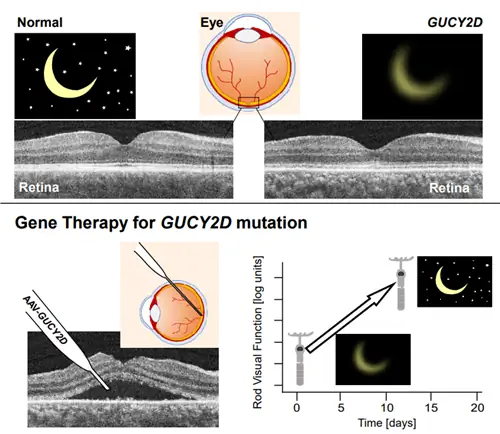
Чтобы сравнить пролеченный глаз с необработанным и определить эффективность лечения, исследователи применяли терапию только к одному глазу у каждого пациента.
Аллен С. Хо, доктор медицинских наук, профессор офтальмологии Университета Томаса Джефферсона и глазной больницы Уиллс, провел операцию на сетчатке. Тесты показали, что чувствительность глаз обоих пациентов к свету увеличилась в тысячи раз при слабом освещении, что значительно устранило первоначальные нарушения зрения.
Итак, исследователи использовали девять взаимодополняющих методов для оценки функционального зрения пациента и светочувствительности. Сюда входили тесты на непроизвольные реакции зрачков на свет и навыки навигации в помещении при слабом освещении.
«Так же поразительна была скорость улучшения после терапии. В течение восьми дней оба пациента уже демонстрировали измеримую эффективность», - сказал Артур В. Цидециан.
Передача зрительных сигналов в мозг начинается с каскада фототрансдукции сетчатки, который преобразует видимый свет из окружающей среды в химические изменения. Нарушение зрения возникает, когда мутации инактивируют белки каскада фототрансдукции. Тяжелая моногенно-наследуемая слепота, врожденный амавроз Лебера (LCA), вызывается мутациями в гене GUCY2D, приводящими к молекулярному дефекту в продукции циклического GMP, вторичного мессенджера фототрансдукции. Мы изучили двух пациентов с GUCY2D-LCA, которые проходили терапию генной аугментации. У обоих пациентов до вмешательства наблюдался значительный дефицит ночного зрения на основе фоторецепторов палочек. В течение нескольких дней терапии палочковидное зрение у обоих пациентов резко изменилось; улучшение зрительной функции и функционального зрения у этих гиперреактивных пациентов достигло более 3 log10 единиц (в 1000 раз), что приближается к здоровому зрению палочек. Таким образом, быстрая активация сложных молекулярных путей от фоторецептора сетчатки к зрительной коре и поведению возможна у пациентов даже после инвалидности и бездействия в течение десятилетий.
