Пластмассы - превосходные материалы: чрезвычайно универсальные и практически вечные. Но именно в этом и заключается проблема, потому что спустя всего лишь около 100 лет производства пластика частицы пластика теперь встречаются повсюду - в грунтовых водах, в океанах, в воздухе и в пищевой цепочке. Ежегодно производится около 50 миллионов тонн промышленно важного полимера ПЭТФ. В настоящее время лишь небольшая часть пластика перерабатывается с помощью дорогостоящих и энергозатратных процессов, в результате которых получаются либо продукты с более низким качеством, либо, в свою очередь, зависит от добавления «свежей» сырой нефти.
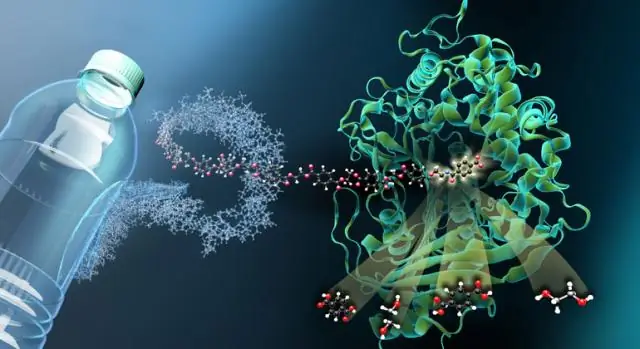
В 2016 году группа японских исследователей обнаружила бактерию, которая растет на ПЭТ и частично питается им. Они обнаружили, что его бактерия обладает двумя особыми ферментами, ПЭТазой и МГЕТазой, которые способны переваривать пластиковые полимеры ПЭТ. ПЭТаза расщепляет пластик на более мелкие строительные блоки ПЭТ, в первую очередь MHET, а MHETase расщепляет его на два основных строительных блока-предшественника ПЭТ, терефталевую кислоту и этиленгликоль. Оба компонента очень ценны для синтеза нового ПЭТФ без добавления сырой нефти - для замкнутого устойчивого цикла производства и извлечения.
В апреле 2018 года структура ПЭТазы была окончательно решена независимо несколькими исследовательскими группами, в экспериментах также участвовал Diamond Light Source. Однако PETase - это только часть решения. Не менее важно охарактеризовать структуру второго фермента, МГЕТазы.
MHETase значительно больше, чем PETase, и даже более сложна. Одна молекула MHETase состоит из 600 аминокислот или около 4000 атомов. MHETase имеет поверхность, которая примерно в два раза больше, чем поверхность PETase, и поэтому обладает значительно большим потенциалом для оптимизации ее для разложения PET», - объясняет биохимик и структурный биолог доктор Герт Вебер из совместной исследовательской группы по кристаллографии белков в Университете Гельмгольца. Zentrum Berlin и Freie Universität Berlin. Во время временного пребывания профессора в Грайфсвальдском университете Вебер связался с биотехнологом профессором Уве Борншойером из Института биохимии, который уже занимался ферментами, разлагающими пластик. Вместе они разработали идею решения структуру MHETase, а затем использовать это понимание для оптимизации фермента для применения в переработке ПЭТ. Для этого им сначала нужно было извлечь фермент из бактериальных клеток и очистить его. В рамках этого сотрудничества командам удалось получить комплекс трехмерная архитектура MHETase в BESSY II, синхротронном источнике в HZB в Берлине.
«Чтобы увидеть, как MHETase связывается с ПЭТ и разлагает его, вам нужен фрагмент пластика, который связывается с MHETase, но не расщепляется ею», - объясняет Вебер. Член предыдущей исследовательской группы Вебера в Грайфсвальде, доктор Готфрид Палм, разрезал ПЭТ-бутылку, химически разложил полимер ПЭТ и синтезировал из него небольшой химический фрагмент, который связывается с МГЕТазой, но больше не может быть расщеплен ею. Из этой «заблокированной» MHETase были выращены крошечные кристаллы для структурных исследований в HZB. «Структурные исследования позволили нам фактически наблюдать за работой MHETase и разработать стратегии оптимизации этого фермента», - объясняет Вебер.
«Благодаря формату совместной исследовательской группы у нас есть средства, чтобы в любое время предложить доступ к высоко востребованным лучевым линиям BESSY II MX для проведения измерений очень быстро», - говорит д-р Манфред Вайс, ответственный за Лучи BESSY II MX. Трехмерная архитектура MHETase на самом деле демонстрирует некоторые особенности: такие ферменты, как MHETase, сначала связываются со своей молекулой-мишенью, прежде чем происходит химическая реакция. Для расщепления молекулы вам нужен специальный фермент: «Теперь мы можем точно локализовать, где молекула MHET стыкуется с MHETase, и как MHET затем разделяется на два строительных блока терефталевую кислоту и этиленгликоль», - говорит Вебер.
Однако ни PETase, ни MHETase пока не особенно эффективны. «Пластик существует в таком масштабе всего несколько десятилетий - даже бактериям с их быстрой сменой поколений и быстрой приспособляемостью не удалось разработать идеальное решение в ходе эволюционного процесса проб и ошибок за такое короткое время», - объясняет Вебер.. «Благодаря выяснению структуры этого очень важного фермента мы теперь также смогли спланировать, произвести и биохимически охарактеризовать варианты, которые демонстрируют значительно более высокую активность, чем природная MHETase, и даже активны против другого промежуточного продукта деградации PET, BHET, - добавляет Уве Борншойер.
В будущем Уве Борншойер будет работать над систематической оптимизацией ферментов PETase и MHETase для их задачи - разложения PET. Герт Вебер планирует дополнить эти исследования дальнейшей работой над биологическими структурами, чтобы систематически разрабатывать ферменты, переваривающие пластик, для применения в окружающей среде. Для этого необходим доступ к измерительным станциям и ИТ-инфраструктуре HZB.
Производство таких ферментов в замкнутых биотехнологических циклах, например, может быть способом действительно разложить ПЭТ-пластик и другие полимеры на их основные строительные блоки. Это также было бы ключом к идеальной переработке и долгосрочному решению проблемы пластиковых отходов: производство пластика стало бы замкнутым циклом и больше не зависело бы от сырой нефти.