Электронная активность в химических реакциях
Глава 11 - Батареи и системы питания
До сих пор в наших обсуждениях электрических и электрических цепей мы не обсуждали подробно, как работают батареи. Скорее, мы просто предположили, что они производят постоянное напряжение через какой-то таинственный процесс. Здесь мы рассмотрим этот процесс в некоторой степени и рассмотрим некоторые практические соображения, связанные с реальными батареями и их использованием в энергетических системах.
В первой главе этой книги обсуждалось понятие атома как основной строительный блок всех материальных объектов. Атомы, в свою очередь, состоят из еще меньших частей вещества, называемых частицами. Электроны, протоны и нейтроны являются основными типами частиц, обнаруженных в атомах. Каждый из этих типов частиц играет определенную роль в поведении атома. Хотя электрическая активность связана с движением электронов, химическая идентичность атома (в значительной степени определяющая, насколько проводящий материал будет) определяется числом протонов в ядре (в центре).
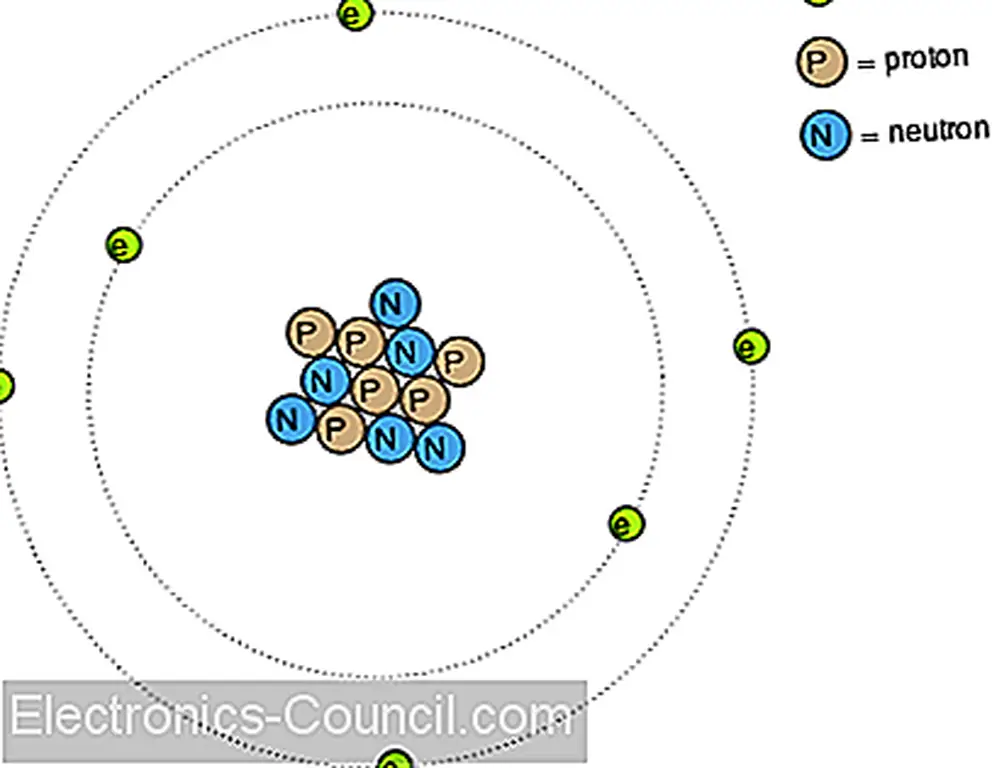
Протон в ядре атома чрезвычайно трудно выбить, и поэтому химическая идентичность любого атома очень стабильна. Одной из целей древних алхимиков (превращение свинца в золото) была сорвана эта субатомная стабильность. Все усилия по изменению этого свойства атома с помощью тепла, света или трения были устранены. Однако электроны атома намного легче вытесняются. Как мы уже видели, трение - это один из способов переноса электронов из одного атома в другой (стекло и шелк, воск и шерсть), а также тепло (генерирование напряжения путем нагревания соединения разнородных металлов, как в случае термопар).
Электроны могут делать гораздо больше, чем просто перемещаться и между атомами: они также могут служить для соединения разных атомов вместе. Это связывание атомов электронами называется химической связью. Грубое (и упрощенное) представление такой связи между двумя атомами может выглядеть так:
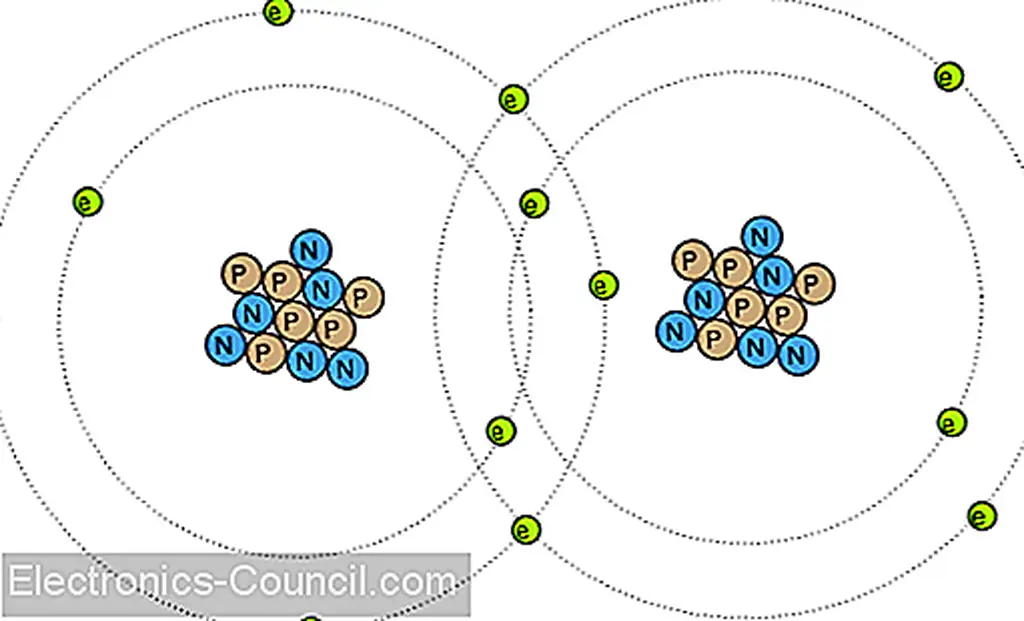
Существует несколько типов химических связей, показанные выше, представляющие собой ковалентную связь, где электроны распределяются между атомами. Поскольку химические связи основаны на звеньях, образованных электронами, эти связи только настолько сильны, как неподвижность электронов, образующих их. Иными словами, химические связи могут быть созданы или разрушены теми же силами, которые заставляют электроны двигаться: тепло, свет, трение и т. Д.
Когда атомы соединяются химическими связями, они образуют материалы с уникальными свойствами, известными как молекулы. Представленная выше двухатомная картина является примером простой молекулы, образованной двумя атомами того же типа. Большинство молекул являются соединениями разных типов атомов. Даже молекулы, образованные атомами одного типа, могут иметь радикально разные физические свойства. Возьмите элементный углерод, например: в одной форме, графит, атомы углерода соединяются вместе, образуя плоские «пластины», которые легко скользят друг относительно друга, придавая графиту свои природные смазочные свойства. В другой форме алмаз, одни и те же атомы углерода соединяются вместе в другой конфигурации, на этот раз в форме взаимосвязанных пирамид, образуя материал с повышенной твердостью. В еще одной форме, фуллерен, десятки атомов углерода образуют каждую молекулу, которая выглядит как футбольный мяч. Молекулы фуллерена очень хрупкие и легкие. Воздушная сажа, образованная чрезмерно богатым сжиганием ацетиленового газа (как при первоначальном зажигании с помощью оксиацетиленовой сварки / резака), содержит много молекул фуллеренов.
Когда алхимикам удалось изменить свойства вещества за счет тепла, света, трения или смеси с другими веществами, они действительно наблюдали изменения в типах молекул, образованных атомами, разрушающими и образующих связи с другими атомами. Химия является современным аналогом алхимии и касается прежде всего свойств этих химических связей и связанных с ними реакций.
Типом химической связи, представляющей особый интерес для нашего исследования батарей, является так называемая ионная связь, и она отличается от ковалентной связи тем, что один атом молекулы обладает избытком электронов, в то время как другому атому не хватает электронов, связи между ними являясь результатом электростатического притяжения между двумя непохожими зарядами.
Когда ионные связи образуются из нейтральных атомов, происходит перенос электронов между положительно и отрицательно заряженными атомами. Говорят, что атом, который получает избыток электронов, уменьшается; считается, что атом с дефицитом электронов окислен. Мнемоника, помогающая вспомнить определения - OIL RIG (окисляется меньше, уменьшается). Важно отметить, что молекулы часто содержат как ионные, так и ковалентные связи. Гидроксид натрия (щелочь, NaOH) имеет ионную связь между атомом натрия (положительным) и гидроксильным ионом (отрицательным). Ион гидроксила имеет ковалентную связь (показанную в виде стержня) между атомами водорода и кислорода:
Na + O-H - натрий только теряет один электрон, поэтому его заряд равен +1 в приведенном выше примере. Если атом теряет более одного электрона, полученный заряд может быть обозначен как +2, +3, +4 и т. Д. Или римской цифрой в скобках, показывающей состояние окисления, такое как (I), (II), (IV) и т. Д. Некоторые атомы могут иметь множественные состояния окисления, и иногда важно включать состояние окисления в молекулярную формулу, чтобы избежать двусмысленности.
Образование ионов и ионных связей от нейтральных атомов или молекул (или наоборот) связано с переносом электронов. Эта передача электронов может быть использована для создания электрического тока. Устройство, построенное для этого, называется вольтовой ячейкой или короткой ячейкой, обычно состоящей из двух металлических электродов, погруженных в химическую смесь (называемую электролитом), предназначенную для облегчения такая электрохимическая (окислительно-восстановительная) реакция:
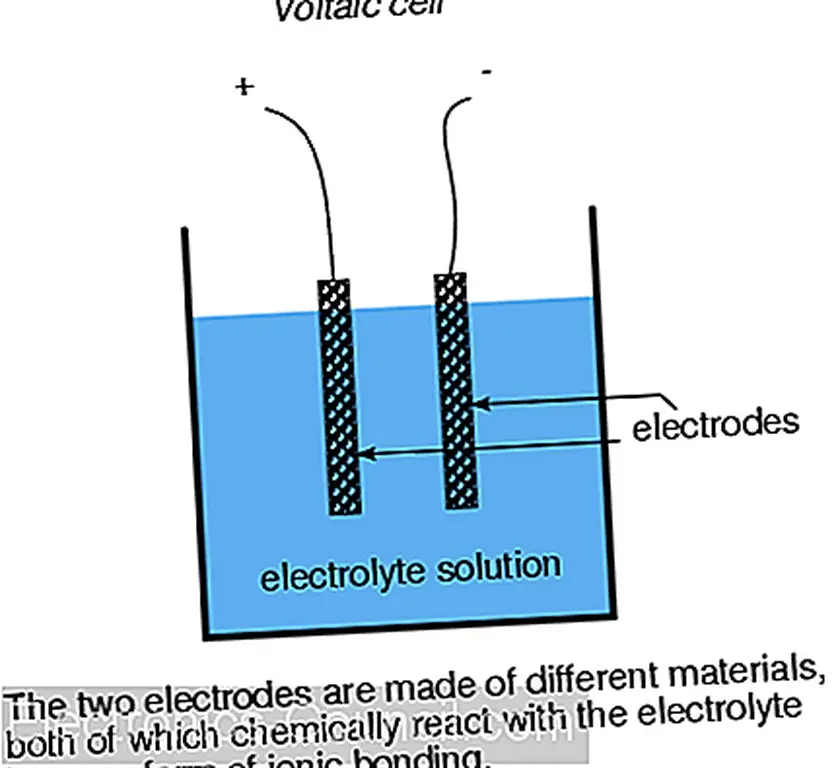
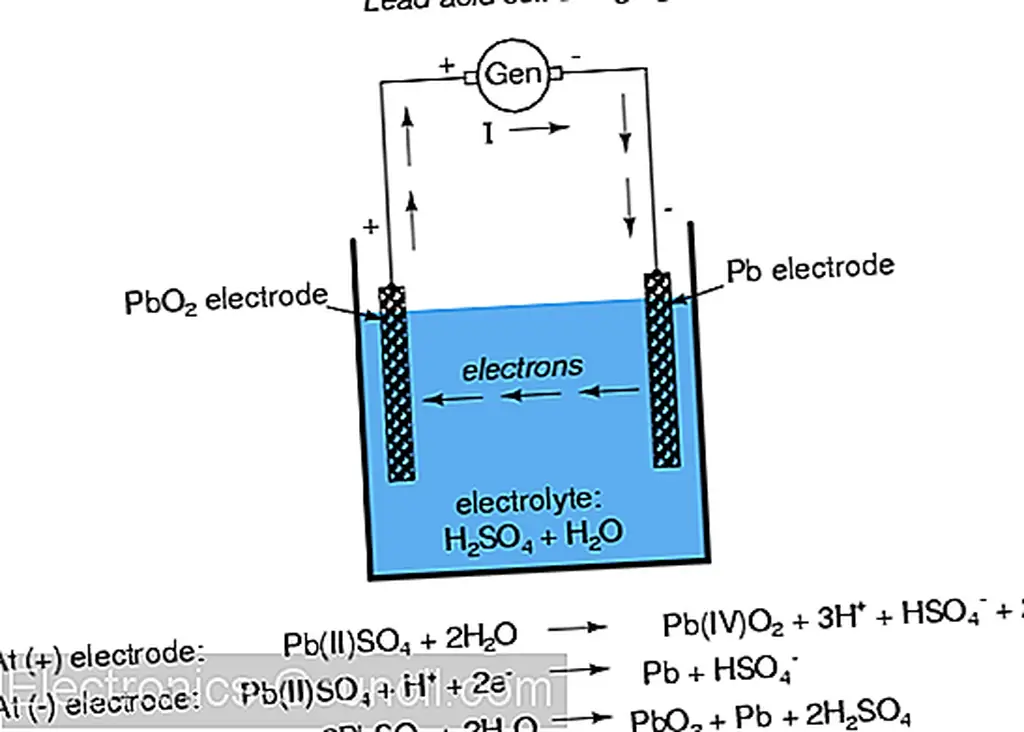
В общей «свинцово-кислотной» ячейке (обычно используемой в автомобилях) отрицательный электрод выполнен из свинца (Pb), а положительный - из диоксида свинца (IV) (PbO 2), обоих металлических веществ. Важно отметить, что диоксид свинца является металлическим и представляет собой электрический проводник, в отличие от других оксидов металлов, которые обычно являются изоляторами. (примечание: таблица). Раствор электролита представляет собой разбавленную серную кислоту (H 2 SO 4 + H 2 O). Если электроды ячейки соединены с внешним контуром, так что электроны имеют место для течения от одного к другому, то атомы свинца (IV) в положительном электроде (PbO 2) будут получать два электрона каждый для получения Pb (II) вывод. Атомы кислорода, которые «оставлены», объединены с положительно заряженными ионами водорода (H) + с образованием воды (H 2 O). Этот поток электронов в электрод диоксида свинца (PbO 2) дает ему положительный электрический заряд. Следовательно, атомы свинца на отрицательном электроде дают два электрона для получения свинца Pb (II), который объединяется с сульфат-ионами (SO 4 -2), полученными при диссоциации ионов водорода (H +) из серной кислоты (H 2 SO 4) с образованием сульфата свинца (PbSO 4). Поток электронов из свинцового электрода дает отрицательный электрический заряд. Эти реакции показаны схематически ниже: (DOE)
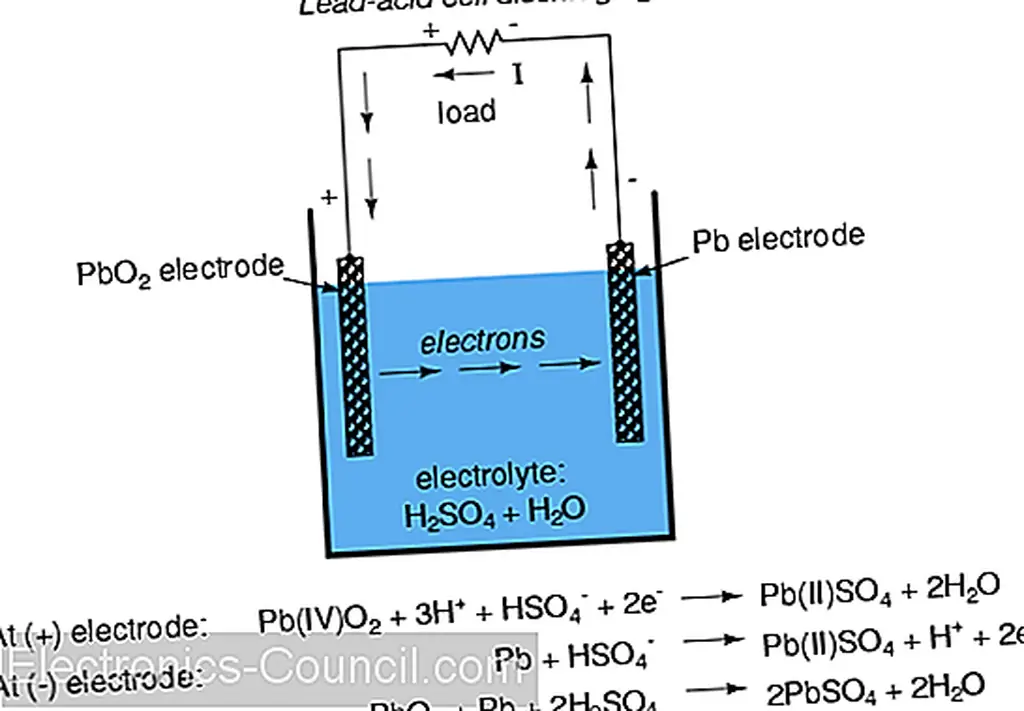
Примечание по номенклатуре оксидов свинца:
| Номенклатура оксидов свинца может вводить в заблуждение. Термин оксид свинца может относиться либо к Pb (II) O, либо к Pb (IV) O 2, и правильное соединение может быть определено обычно из контекста. Другие синонимы для Pb (IV) O 2: диоксид свинца, пероксид свинца, оксид кальция, оксид свинца, коричневый и супероксид свинца. Термин пероксид свинца особенно запутан, так как он подразумевает соединение свинца (II) с двумя атомами кислорода Pb (II) O2, которое, по-видимому, не существует. К сожалению, термин пероксид свинца сохраняется в промышленной литературе. В этом разделе диоксид свинца будет использоваться для обозначения Pb (IV) O2, а оксид свинца будет относиться к Pb (II) O. Обычно состояния окисления не отображаются. |
Этот процесс ячейки, обеспечивающей электрическую энергию для подачи нагрузки, называется разрядкой, поскольку он истощает свои внутренние химические запасы. Теоретически, после исчерпания всей серной кислоты, результатом будет два электрода сульфата свинца (PbSO 4) и раствор электролита чистой воды (H 2 O), не оставляя больше возможностей для дополнительного ионного связывания. В этом состоянии ячейка, как говорят, полностью разряжена. В свинцово-кислотной ячейке состояние заряда может быть определено анализом прочности кислоты. Это легко осуществить с помощью устройства, называемого ареометром, который измеряет удельный вес (плотность) электролита. Серная кислота плотнее воды, поэтому чем больше заряд ячейки, тем больше концентрация кислоты и, следовательно, более плотный раствор электролита.
Не существует единой химической реакции, представляющей все вольтовые ячейки, поэтому любое подробное обсуждение химии обязательно ограничено. Важно понять, что электроны мотивированы и / или электронами клетки через ионные реакции между молекулами электрода и молекулами электролита. Реакция активируется, когда есть внешний путь для электрического тока и прекращается, когда этот путь нарушается.
Будучи тем, что побуждение электронов двигаться по клетке носит химический характер, величина напряжения (электродвижущая сила), генерируемого любой ячейкой, будет специфичной для конкретной химической реакции для этого типа ячейки. Например, только что описанная свинцово-кислотная ячейка имеет номинальное напряжение 2, 04 вольта на ячейку, основанную на полностью «заряженной» ячейке (сильная концентрация кислоты) в хорошем физическом состоянии. Существуют и другие типы ячеек с различными выходными напряжениями. Например, ячейка Эдисона с положительным электродом из оксида никеля, отрицательным электродом из железа и электролитным раствором гидроксида калия (каустической, некислотной, веществом) генерирует номинальное напряжение всего 1, 2 вольта из-за специфические различия в химической реакции с этими электродами и электролитами.
Химические реакции некоторых типов ячеек могут быть отменены путем вытеснения электрического тока назад через ячейку (в отрицательный электрод и из положительного электрода). Этот процесс называется зарядкой. Любая такая (перезаряжаемая) ячейка называется вторичной ячейкой. Ячейка, химия которой нельзя изменить обратным током, называется первичной ячейкой.
Когда свинцово-кислотная ячейка заряжается внешним источником тока, химические реакции, возникающие во время разряда, меняются на противоположные:
- ОБЗОР:
- Атомы, связанные вместе электронами, называются молекулами.
- Ионные связи представляют собой молекулярные союзы, образованные, когда электрон-дефицитный атом (положительный ион) соединяется с избыточным электроном атомом (отрицательным ионом).
- Электрохимические реакции связаны с переносом электронов между атомами. Эта передача может быть использована для формирования электрического тока.
- Ячейка представляет собой устройство, сконструированное для использования таких химических реакций для генерирования электрического тока.
- Считается, что клетка разряжается, когда ее внутренние химические запасы истощены путем использования.
- Химия вторичной клетки может быть отменена (перезаряжена), заставляя ее обратно через нее.
- Первичная ячейка не может быть практически перезаряжена.
- Слиток свинцово-кислотной ячейки можно оценить с помощью прибора, называемого ареометром, который измеряет плотность электролитной жидкости. Чем плотнее электролит, тем сильнее концентрация кислоты и большее зарядное состояние клетки.

