Микробиом с рисками и побочными эффектами
Когда мы принимаем лекарства, иногда они не работают должным образом. Одна из причин этого: микробы в нашем кишечнике. Очевидно, их аппетит варьируется от человека к человеку.
Микробы, населяющие наш кишечник, оказывают большое влияние на наше здоровье. Например, они помогают определить, насколько хорошо действуют лекарства, которые мы принимаем. Потому что некоторые кишечные бактерии могут что-то делать с активными ингредиентами. Что, однако, отличается от человека к человеку. Потому что наш микробиом содержит сотни различных бактериальных штаммов, оснащенных широким спектром метаболических ферментов. Кроме того, микробы присутствуют в индивидуально разной пропорции.
До сих пор это мешало многим исследователям систематически изучать взаимодействие нашего микробиома с различными лекарствами. Не так обстоят дела с командой под руководством молекулярного биолога Мохамеда Дониа из Принстонского университета: «Мы не прячемся от сложности микробиома, мы принимаем ее», - говорится в пресс-релизе университета.
Исследователи изучили образцы стула 21 человека и составили каталог содержащихся в них бактерий на основе их генетического строения. Затем команда воспроизвела микробиомы в лаборатории и накормила их в общей сложности 438 различными лекарствами, включая антибиотики, обезболивающие, антидепрессанты, лекарства от рака и лекарства от болезни Паркинсона..
Результаты этого обширного теста, который исследователи называют «Скрининг метаболизма на основе микробиома», представлены в специализированном журнале «Cell». В целом команда Донии определила 57 препаратов, на которые тестовые микробиомы оказали значительное влияние. О 45 из них даже не было известно, что они могут быть преобразованы кишечными бактериями. Ученые наблюдали большие различия между отдельными донорами: в то время как микробиом одних людей практически не влиял на некоторые лекарства, кишечные бактерии других быстро их перерабатывали.
Кишечные бактерии могут вызывать побочные эффекты
Расщепление лекарств в нашем организме является нормальным и желательным - в конце концов, мы обычно не хотим, чтобы они оказывали длительное действие. Некоторые наркотики становятся активными только в результате определенных преобразований. Но это обычно делается ферментами в нашей печени, а не бактериями в кишечнике.
«Роль микробиома в метаболизме лекарств до сих пор недооценивалась», - говорит Тилль Штровиг из Центра исследований инфекций им. Гельмгольца в Брауншвейге. В нашем метаболизме активно участвуют не только наши собственные ферменты, но и ферменты бактерий, объясняет микробиолог.
Таблетки, капсулы или соки, которые мы принимаем перорально, сначала попадают в желудок, а затем в кишечник. Там активные ингредиенты поглощаются клетками слизистой оболочки и выбрасываются в кровь - при условии, что наши кишечные бактерии их еще не съели. Это не только снижает желаемый эффект лекарства, но и может вызвать нежелательные побочные эффекты: бактерии иногда производят продукты метаболизма, которые мы не переносим.
Например, команда Дониа заметила, что микробиомы некоторых доноров преобразовали химиотерапевтический препарат доксифлуридин в его активную форму 5-фторурацил. Это вещество уничтожает раковые клетки. Однако, по словам исследователей, если он уже присутствует в кишечнике, он может вызывать тошноту и рвоту - побочные эффекты, обычно приписываемые препарату.
Майкл Циммерманн из Европейской лаборатории молекулярной биологии (EMBL) в Гейдельберге предполагает, что наш микробиом отвечает за некоторые побочные эффекты, вызываемые лекарствами. Это уже известно для некоторых препаратов. «Активные ингредиенты, модифицированные кишечными бактериями, могут привести к нежелательным эффектам в организме и, из-за физической близости, часто к проблемам в желудочно-кишечном тракте», - говорит микробиолог.
Однако трудно сказать, какая часть таких побочных эффектов связана с нашим микробиомом. Чтобы исследовать это систематически, необходимо отделить микробиом от его хозяина и доказать, что определенные реакции вызываются исключительно содержащимися в нем бактериями, говорит Кристоф Калета из Университета Кристиана Альбрехта в Киле. Такие исследования сложны и до сих пор проводились только для отдельных лекарств с использованием мышиных моделей, объясняет системный биолог и биоинформатик.
Микробиом человека в деталях
Что Калете нравится в исследовании, проведенном командой Донии, так это не только то, что был протестирован относительно большой набор лекарств, но и то, что «исследователи прошли весь путь от высокопроизводительного метода до детальных исследований». В общей сложности для 23 активных ингредиентов рабочая группа внимательно изучила, какие метаболиты образовались, и попыталась ретроспективно определить, какие бактериальные штаммы были ответственны за это.
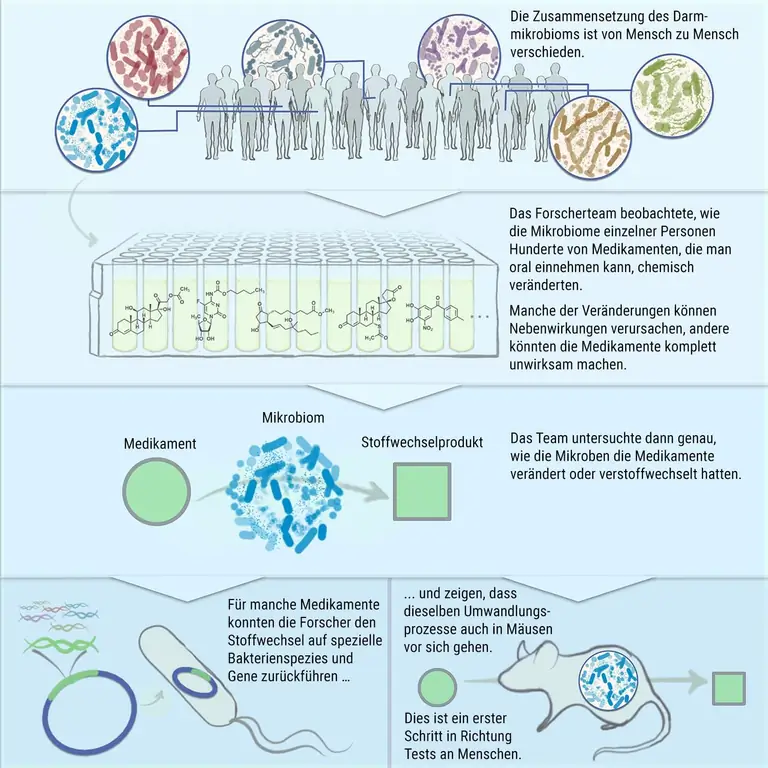
Сможет ли бактерия превратить лекарство и в какой продукт, зависит от ее ферментативного оборудования. Это зафиксировано в геноме. Чтобы на примере проверить, верны ли их подозрения, исследователи отключили гены подозреваемых ферментов у определенного штамма бактерий. И действительно: эти бактерии больше не могли преобразовывать лекарство - в данном случае капецитабин, лекарство от рака.
Большую часть времени, однако, не только один бактериальный штамм ответственен за превращение лекарства: как обнаружили Дония и его коллеги, 17 из 21 доноров микробиома имели различные бактериальные штаммы, которые могут превращать капецитабин в ранее неизвестный метаболит дегликокапецитабин. Чтобы выяснить, имеет ли место эта реакция и в живом организме, они парализовали кишечный микробиом лабораторных мышей антибиотиками, а затем имплантировали им микробы от человека-донора. Всего через 20 минут после того, как мыши съели дозу капецитабина, в их кишечнике можно было обнаружить метаболит дегликокапецитабин..
Это свидетельствует о том, что наблюдаемые метаболические процессы происходят не только в пробирке, пишет команда. Однако еще не подтверждено, действительно ли они встречаются в кишечнике человека.
Общий пакет имеет решающее значение
Изучение того, как кишечные бактерии влияют на метаболизм лекарств, не является новой идеей, говорит Стровиг. Микробиолог и его коллеги исследуют, как наше микробное сообщество влияет на течение инфекционных заболеваний. В последние годы на это все чаще обращают внимание.
Например, группа под руководством Питера Тернбо из Гарвардского университета обнаружила, что бактериальный штамм Eggerthella lenta инактивирует сердечный препарат дигоксин. В 2019 году группа под руководством Эндрю Гудмана из Медицинской школы Йельского университета провела систематическое исследование почти 300 лекарств. Исследователь EMBL Циммерманн также принимал участие в этом. Ученые вводили препараты 76 различным штаммам бактерий. Результат: около двух третей исследованных лекарств могут быть обработаны бактериями; каждый штамм содержит от 11 до 95 активных ингредиентов.
На сегодняшний день, однако, почти ни одно исследование не изучало, как микробиом человека в целом влияет на действие наркотиков. Это особенно важно, потому что текущие метаболические процессы могут влиять друг на друга, - говорит Дония.
Шаг к персонализированной медицине
И влияние микробиома, вероятно, идет еще дальше: исследования команды Калеты показывают, например, что метформин, лекарство от диабета, стимулирует кишечные бактерии червей к выработке определенного вещества. Это улучшает жировой обмен червей и делает их более здоровыми. По словам Калеты, методы, используемые командой Дониа, также должны позволять обнаруживать химические соединения, которые не образуются непосредственно при расщеплении наркотиков. Однако, по-видимому, они не получили дальнейшего рассмотрения в следствии. Кроме того, некоторые лекарства и их метаболиты могут влиять на состав микробиома, что также может иметь негативные последствия для здоровья.
Стровиг также считает работу команды ценным ресурсом. Однако он не считает, что представленный метод подходит для проверки сотен лекарств на наличие потенциальных побочных эффектов у людей. В 21 год количество доноров микробиома все еще довольно мало. Скорее, он считает практичным противоположный подход: в будущем образцы стула будут исследоваться у лиц, которые должны получить конкретное лекарство.
Возможно, можно выявить определенные ферменты-маркеры или бактериальные штаммы, которые указывают, могут ли возникнуть осложнения после приема внутрь, говорит микробиолог. По словам Стровига, это было бы особенно полезно для лекарств, которые принимаются в течение длительного периода времени, таких как ВИЧ, диабет или сердечно-сосудистые препараты. Таким образом, может быть проще найти эффективный и хорошо переносимый препарат и правильно подобрать дозировку. До этого еще далеко. Тем не менее, исследование Дониа и его коллег может помочь исследователям достичь этого в ближайшие несколько лет и, таким образом, сделать еще один шаг к персонализированной медицине, говорит Стровиг..
